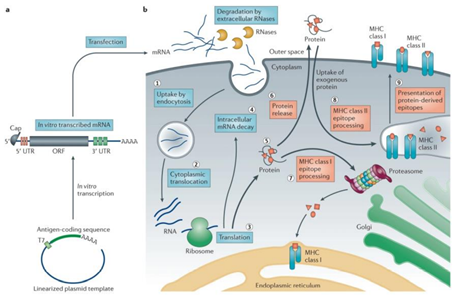
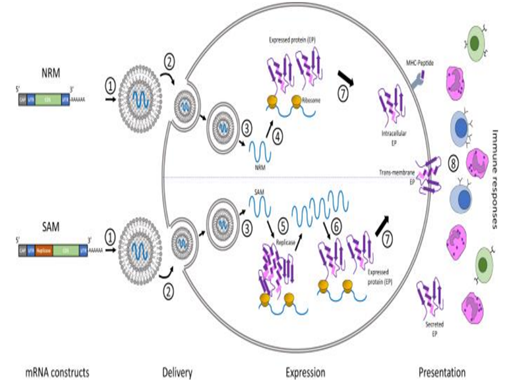
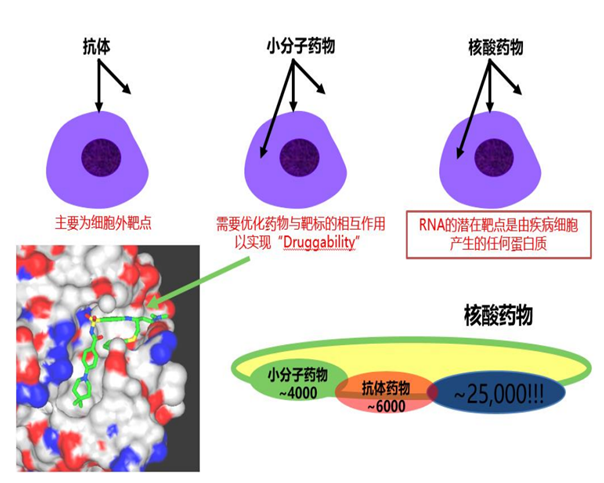
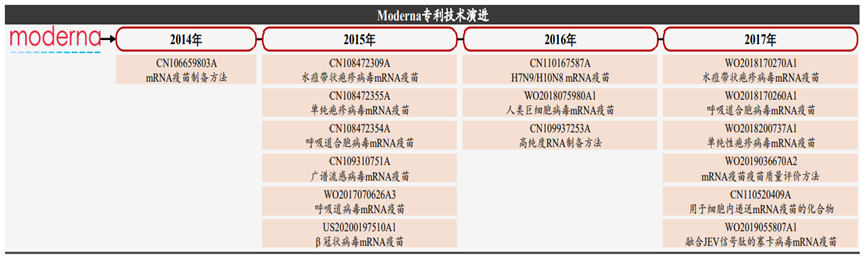
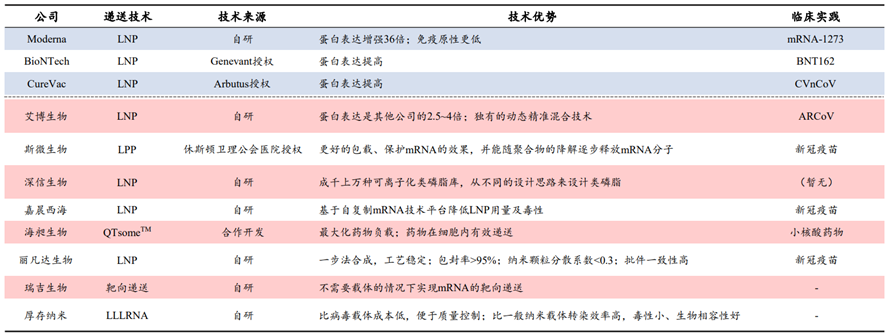
自新冠疫情爆发以来,mRNA疫苗的研发进程一直受到全球密切关注,mRNA疗法布局成为各大药企积极布局的重要赛道。信使RNA作为生命活动的直接指令单元, 是DNA与蛋白质之间的直接桥梁,关于mRNA疗法的雏形,早在1990年,科学家就曾将体外转录的mRNA注射入小鼠体内,检测发现其可以在小鼠体内表达活性,产生相关蛋白并且具有剂量依赖性,这种直接注射产生了免疫反应,也就表明了mRNA疫苗的特性。但是受当时技术限制,在mRNA稳定性,药物递送,还有安全性等方面存在瓶颈,这种疗法逐渐趋冷,更多研究者转向DNA和替代蛋白领域。时间进入21世纪,mRNA合成、修饰技术和递送技术的发展让mRNA疗法重返生物制药公司的视线。mRNA疗法最早应用在肿瘤治疗中,通过将编码细胞因子等特定蛋白的mRNA注射到肿瘤内,起到激活免疫应答的作用。当体外转录的mRNA递送到人体后,兼具着抗原呈递和自佐剂两方面的作用。首先,胞质内少量mRNA就可以实现抗原呈递到CTL细胞,而蛋白质只能依赖效率较低的交联提呈途径;机体可以通过mRNA可持续地获得抗原,在抗体广度和亲和力方面 显著优于蛋白质相关疫苗,带来更持久的保护。此外,mRNA相较 蛋白质可递呈抗原种类更丰富,mRNA能编码全长蛋白质,因此可避免病人MHC半抗原限制。同时,通过串联结构设计可以将多种 抗原表型组装在一条mRNA链中。其次就是自佐剂的作用,内体中的mRNA会被多种模式识别受体(PRR)识别,促进I型干扰素(IFN-I)和其他促炎细胞因子(如IL-6和TNF-α)的产生。IFN-I对mRNA的影响具有两面性。相比于各类传统药物,mRNA药物具有其优劣势。小分子化药通过与靶点蛋白结合发挥治疗作用,但可成药的靶点蛋白数量有限,靶向性差因此无法从机制上治疗疾病。在小分子药物之后,以抗体药物为主的生物药逐渐出现,与小分子化药相比,抗体药物可作用的靶点蛋白种类更多,且可通过蛋白质工程技术提升其亲和性降低毒性等。但是抗体类药物拥有分子结构更加复杂、生产成本更高、通常需通过注射给药等劣势,并且抗体药物通常只能与细胞膜表面或细胞外的蛋白质发挥作用,使得其应用受到一定限制。相比之下,核酸类药物拥有明显的优势。核酸类药物可基于碱基互补原理对表达相关蛋白质的基因进行调节,如ASO、siRNA、miRNA、saRNA等,而非与靶点蛋白质进行结合,且通过合适的递送系统可使其进入细胞内发挥作用,而且对胞内外和细胞膜蛋白均可发挥调节作用。同时,多数核酸类药物的作用基础是碱基互补配对原则,只需知道靶基因的碱基序列,核酸药物的序列设计就十分容易,化学修饰和递送系统的设计与序列的设计也是相对独立的,因此可直接快速翻译成蛋白质,半衰期短、代谢产物天然,没有持续和积累性,研发周期快,而小分子和抗体药物的发现和优化过程中,对活性、PKPD等性质的优化均需要对结构做改动,需要花费大量的工作。mRNA的稳定性和递送效率一直是限制因素,细胞外存在大量RNase可以将大部分进入体内的mRNA降解,只有小部分mRNA可以逃脱RNase进入细胞内。因此,mRNA要想成药,需要有一定的递送系统包被。进入细胞内的mRNA翻译效率也是另一个制约其成药性的问题。mRNA代谢路径与其进入细胞的方式有关,传统胞饮或者脂嗜的内吞路径与内吞体代谢相关,因此如何提升内吞体逃逸效率是传统mRNA提送一大难题。提高mRNA稳定性及翻译效率是mRNA走向临床应用必须要跨越的障碍。目前,提高mRNA的稳定性和翻译效率,主要通过mRNA结构化学优化以及递送系统的优化。由于mRNA药物半衰期有限,无法长期表达等缺点,外源核酸药物要想进入体内发挥作用,应考虑如何存留足够时间以准确靶向到病变部位,同时避免损伤正常细胞,归根结底是研发出高效安全的药物递送系统,首先需要避免被快速清除并延长半衰期,较好的解决方法为通过PEG化降低肾脏清除速率,或者制成纳米粒结构(通常在10–200nm),可使其高于肾脏清除的分子量界限。此外核苷酸的化学修饰可降低核酸药物对核酸酶的敏感性,制成纳米粒结构可以避免核酸药物在递送过程中与核酸酶直接接触。对递送系统的修饰可以增强核酸药物在靶组织的摄取效率,比如纳米粒结构可使得提高核酸药物在肝脏,脾脏或肿瘤等组织中的渗透性,提高与靶细胞结合和细胞摄取效率。尽管化学修饰可以改善核酸药物的稳定性和免疫原性,核酸药物需进入细胞内才可以发挥作用,由于核酸药物分子量较大且通常带负电荷,因此被细胞摄取的效率和内吞体逃逸的效率比较低,因此需借助递送系统的力量。脂质类是目前核酸药物中研究应用最多的递送系统之一,且已经有使用脂质纳米颗粒递送系统的核酸药物获批,根据其性质和结构的不同其可以分为脂质体、脂质纳米颗粒(LNP,lipid nanoparticle)等,目前研究中用的较多的包括含有可离子化脂质的LNP。2017年后,生物医药产业第三次革命-核酸药物开始初露峥嵘,核酸药物相关公司市值进入快速增长期。核酸药物种类多,核酸药物以ASO、RNAi和mRNA药物最为成功,目前这三类药物均已有相关产品上市,商业化最为成功的药物是 Spinraza,截至2019年底销售额已累计超过47亿美元。mRNA药物在疫情前已经备受市场关注。在mRNA疗法领域,CuerVac、Moderna、BioNTech被称为“mRNA国际三巨头”,CureVac成立最早,于2000年成立,而Moderna和BioNTech分别于2010和2008年成立,三家公司都在2018年后IPO。Moderna更是在2018年创下生物技术公司IPO最高纪录,当时市值就达到了76亿美金。资本市场对于mRNA药物之前主要的质疑为未有产品上市,成药性有待检验,在本次新冠疫情中,mRNA疫苗彰显了巨大优势和平台化能力,打破了诸多质疑。其中肿瘤是RNA疗法的主要开发方向,mRNA候选药物中肿瘤类项目占45%。根据蛋白功能的不同区分,mRNA药物的有主要用途,第一个是蛋白替换疗法,也就是将人体变成自身蛋白加工厂;肿瘤免疫,激活免疫系统或去除免疫抑制,如细胞因子和抗体;传染病及个性化肿瘤疫苗,帮助人体识别外来病毒或肿瘤新生抗原;最后就是基因编辑技术。未来对于mRNA药物研究的核心不在于验证疫苗市场的大小,而在于理顺mRNA可以在哪些治疗领域真正发挥作用。在新冠疫苗的催化下,mRNA疫苗已迅速走出实验室并迎来商业化,理论上来讲mRNA疫苗或治疗品种的放大生产具有较强的可复制性,核心是成功的序列修饰和递送系统组装。但放大生产产业链更重要,仅以原料为例,就涉及酶、核苷酸、脂质体等上百种,其中具有合成壁垒的酶、脂质体等可能由少数供应商供应。正是这些序列修饰、递送平台技术上的细微差异,对管线临床数量以及市值产生了巨大的影响,至2021年七月,CureVac拥有14条产品管线以及4个临床项目,当前市值91.92亿美元,Moderna拥有24条产品管线,15个临床项目,市值高达1419.8亿美元。纵观Moderna专利技术的演进路线,涉及了载体、RNA合成方法、递送材料、抗原免疫性以及质控评价方法等多个技术分支,相互作用相辅相成,其核苷修饰技术,递送技术以及大规模生产的能力都在这次新冠疫情中得到有力验证。资料来源:Biotechnology Advances,CNABS,DWPI,浙商证券研究所纵观国内,多家本土公司大多集中于开发新冠mRNA疫苗中,据了解,国内目前已有多家研发型mRNA疫苗企业,但均处于起步阶段,暂未有产品获批上市。从技术平台看,国内RNA公司在序列编辑、递送系统领域也有所突破。由于动物环境和人体环境差异较大,递送系统在人体内效率、mRNA 稳定性等都需要大量临床实验予以进一步验证,CureVac在早期研究中,其制剂方式是一半的mRNA搭载于鱼精蛋白中,另一半计量是游离的mRNA单体,从此开发新型狂犬疫苗。在动物阶段疫苗免疫原性尚可,但其临床I期失败了,原因就是其免疫原性不够,疫苗免疫后血清阳转率最优条件下也仅有17/21(狂犬疫苗的阳转率必须达到100%才算成功)。此外,国内外mRNA企业纷纷进行自研递送系统尝试,体外/动物试验结果良好,递送系统免疫原性、稳定性、安全性等有待临床试验进一步验证。资料来源:公司官网,CDE,国家知识产权局,浙商证券研究所全球的机构投资者也已经意识到了mRNA技术领域中的机会。据相关统计,过去五年,约有80多个项目筹集了超过90亿美元的资金,与2019年相比,2020年mRNA技术领域的投资金额大幅增加,增幅约70%。随着mRNA技术的逐步成熟,资本将进一步集中。相比而言,国内mRNA制药领域发展起步相对较晚,但是随着资本市场的投入,更多企业的布局,技术的逐步成熟,相信国内mRNA制药行业未来可期。
文章来源:生物制药小编