尽管COVID-19的持续影响,FDA的药品评价和研究中心(CDER)机构2020年的批准药物数量并没有下滑。CDER于2021年批准了50种新型治疗药物,在近5年平均每年批准51种药物,而在十年前仅为24种。
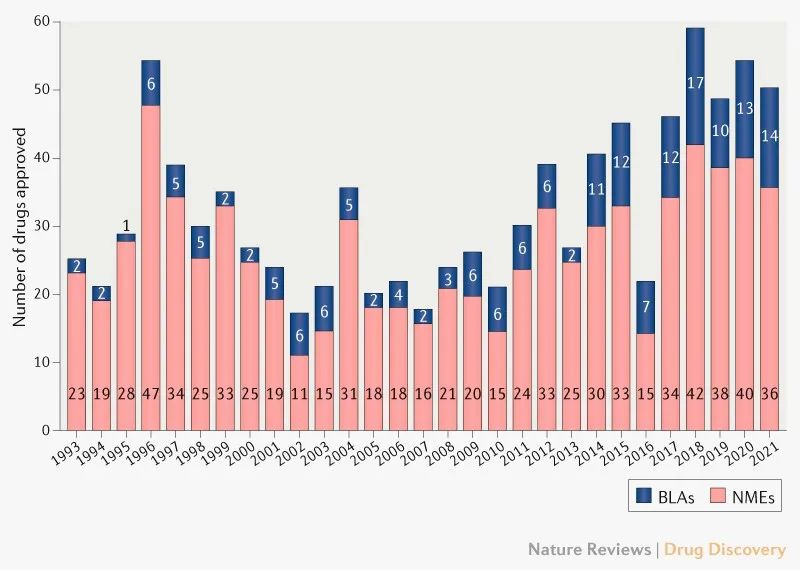
图1.自1993年以来获批的FDA药物
表1. 2021年CDER获批药物汇总
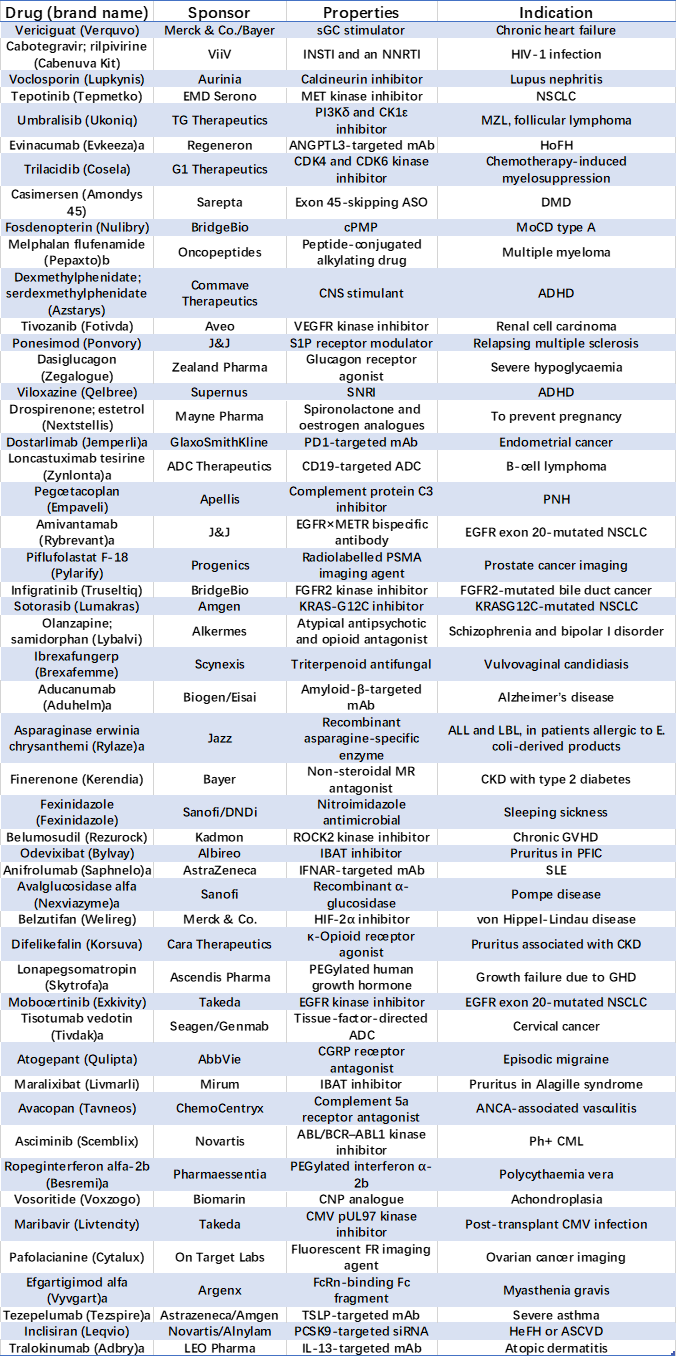
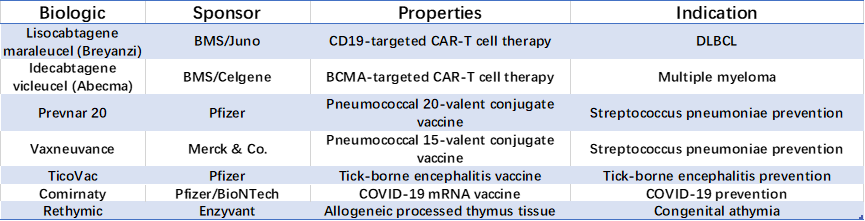
表2.CBER获批药物
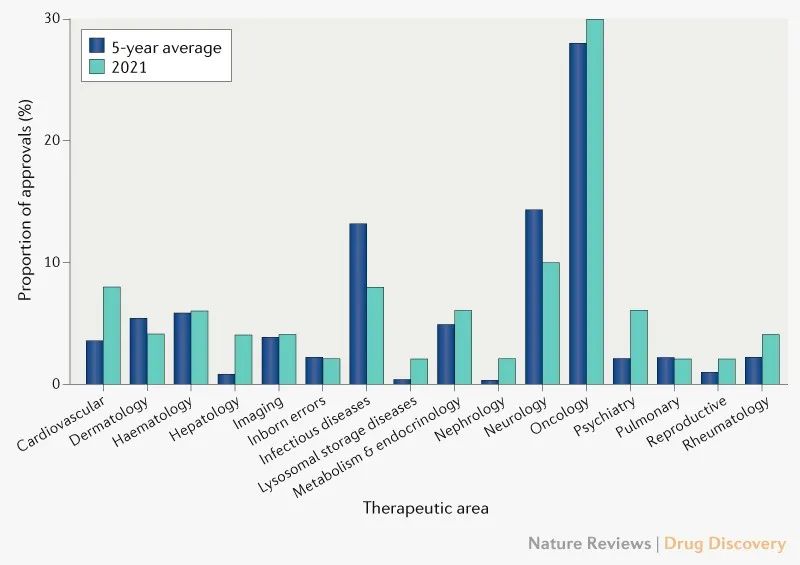
肿瘤获批药物仍然处于主导地位,占新获批药物的30%(图2),排名第二的是神经学药物,第三是感染性疾病和心血管疾病。
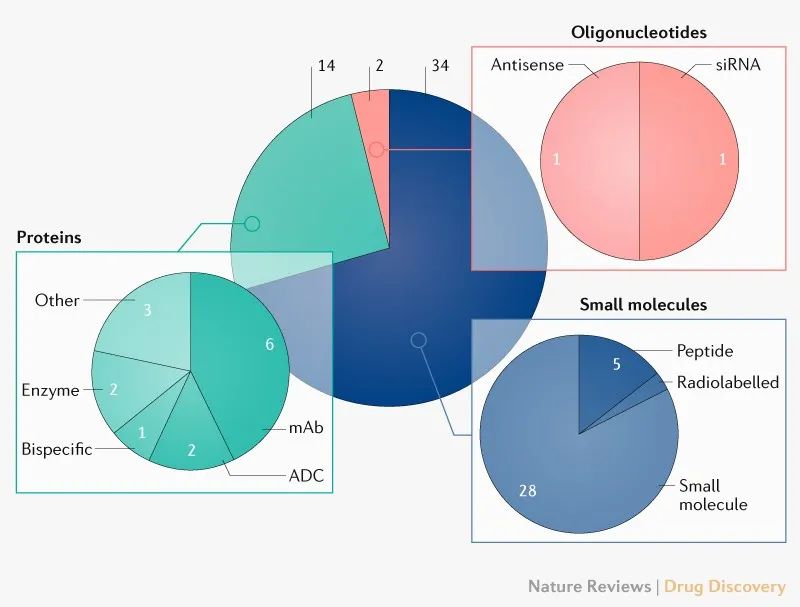
CDER批准的药物包括第100种抗体、2种抗体-药物偶联物(ADC)、1种双特异性抗体、1种限制性肽和2种寡核苷酸药物(图3)。
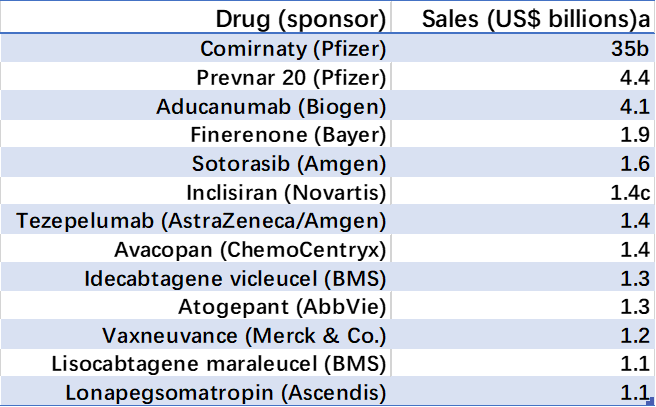
然而,这些获批药物的前景尚不明朗,分析学家预测只有8款药物可以达到重磅地位。其中,Biogen公司的aducanumab是其中唯一一个被预测突破20亿美元大关的药物。
表4.2021重磅药物
疫苗的胜利
疫苗在2021年获得了巨大的成功,尤其是辉瑞和BioNTech的mRNA疫苗tozinameran(Comirnaty)开创了新的先例。
BioNTech于2020年1月开始研发COVID-19的这种mRNA疫苗,并于3月与辉瑞合作。II/III期试验于7月开始,提供了良好的安全性和疗效数据。2021年8月完全批准,即该方案开始后1.5年。而事实上,疫苗发现和开发时间为10.7年。Tozinameran也在打破商业记录,分析师预测,2021年的销售额将超过350亿美元。这些成功推动了mRNA技术——用于流感、其他传染病和癌症的投资激增。
肿瘤界的重大时刻
安进公司的KRAS-G12C抑制剂sotorasib的获批是癌症界的一大时刻。研究人员在40多年前确定了KRAS是一种原癌基因,并发现它是癌症中最常突变的基因之一。但由于缺乏结合口袋,药物的研发处于长期失败阶段。2013年,加州大学旧金山分校的化学生物学家Kevan Shokat发现了该酶G12C变异体上的一个变构口袋,为该靶点成药提供重要条件。
FDA批准了首个缺氧诱导因子-2α(HIF-2α)抑制剂用于治疗与von Hippel-Lindau(VHL)疾病相关的肿瘤。VHL是一种与血管化肿瘤良好相关的遗传性疾病,几十年来对VHL疾病生物学的研究表明,HIF-2α是氧传感的关键驱动因子——为新型抗血管生成药物铺平道路。
BMS的idecabtagene vicleucel获批用于治疗多发性骨髓瘤后,肿瘤医生也有了靶向BCMA的CAR-T细胞疗法。FDA于2020年批准了首个靶向BCMA的生物制剂——葛兰素史克的ADC belantamab mafodotin。Idecabtagene vicleucel提供了一种细胞治疗选择:从患者体内收获T细胞,经修饰后离体靶向BCMA,然后重新输注至患者体内。
随着FDA为葛兰素史克的PD1靶向单克隆抗体(mAb)dostarlimab亮起绿灯,这已经是FDA批准的第100款单克隆抗体。FDA于1986年批准了第一个抗体,目前每年批准约10种抗体产品。
FDA于2021年批准了两个ADC。ADC Therapeutics的loncastuximab tesirine是一种靶向CD19的ADC,用于B细胞淋巴瘤。
J&J的amivantamab也于2021年获得批准,amivantamab是一种靶向EGFR和MET的双特异性抗体,用于治疗EGFR外显子20突变的NSCLC,这些癌症对小分子EGFR抑制剂耐药。当amivantamab与任一受体的胞外域结合时,阻断配体结合,促进受体-抗体复合物内吞和降解,并触发trogocytosis和抗体依赖性细胞毒性。
FDA还批准了武田的mobocertinib,这是一种小分子激酶抑制剂,旨在选择性靶向20号外显子突变的EGFR,用于相同的适应症。
最具争议的阿尔茨海默病
FDA批准Biogen和卫材的降淀粉样蛋白β抗体aducanumab是2021年最有争议的决定。
2019年初,对aducanumab治疗阿尔茨海默病的两项III期试验的中期分析未能发现活性证据,促使Biogen停止开发。但该公司随后对数据进行了重新分析,发现可能存在一定的效果,于是重新提交获批申请。
2020年11月,一个独立的FDA顾问小组以10票对0票,1票弃权反对批准。这些专家质疑Biogen的统计方法和声称效应的临床意义。
分析师仍在预测,到2027年该药的销售额达到41亿美元。但销售开始缓慢,美国一些治疗中心拒绝开具抗体处方。欧洲监管机构拒绝了这种抗体,日本监管机构似乎也准备效仿。该产品的商业成功将取决于美国65岁及以上人群的国家保险计划医疗保险是否涵盖该产品。
其他亮点有哪些?
随着诺华和Alnylam的inclisiran的批准,第四种基于siRNA的药物已经到来。Inclisiran通过抑制PCSK9降低LDL-胆固醇。FDA于2015年批准了两种靶向PCSK9的抗体——赛诺菲的alirocumab以及安进的evolocumab——用于心血管疾病风险增加的患者亚组。
Regeneron以其首创的ANGPTL3靶向mAb evinacumab在心血管领域拔得头筹。Regeneron于2017年在动脉粥样硬化性心血管疾病中对这一靶点进行了基因验证。
阿斯利康和安进的tezepelumab是首个针对重度哮喘的TSLP导向mAb。TSLP是一种IL-7样细胞因子,可调节多个炎症级联反应,并可触发与肺部疾病相关的过敏、嗜酸性粒细胞和其他形式的炎症。Tezepelumab是唯一获批用于重度哮喘的生物制剂,分析师预计到2027年,销售额将达到14亿美元。
阿斯利康的anifrolumab是十年来首个获批用于系统性红斑狼疮(SLE)的新药。许多SLE患者的I型干扰素水平升高,干扰素信号转导突变与疾病易感性相关。Anifrolumab通过与I型干扰素受体结合阻断这些细胞因子的活性。
ChemoCentryx公司的avacopan于2021年获得FDA批准用于ANCA相关血管炎,是首个获得批准的补体结合5a受体拮抗剂。
FDA对这些药物说“不”
FDA去年也拒绝了几项药物申请,例如CD3靶向mAb teplizumab,用于延缓高危个体的1型糖尿病。辉瑞和礼来今年停止了其NGF靶向mAb tanezumab的开发。
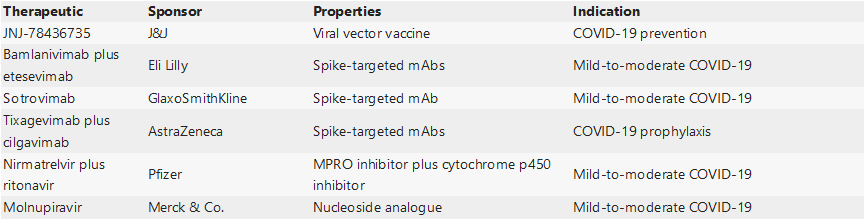
表5.FDA2021拒绝获批的药物
参考文献
https://www.nature.com/articles/d41573-022-00001-9













