长久以来,业内以遵循中心法则的流动方向来开发药物,以 DNA、RNA,以及蛋白质为靶点的药物层出不穷。
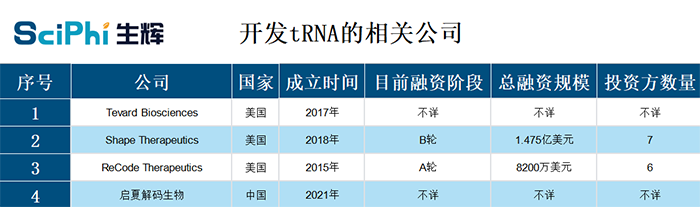
随着 “万能魔剪” CRISPR 的发展,基因疗法和基因编辑日益发展成为治疗遗传性疾病最具潜力的技术手段。随着科学家和投资人逐渐意识到这些疗法的局限性,科学家们开始从传统的以 DNA、mRNA,以及蛋白质为靶点的药物研发框架中跳脱出来,开始重新审视药物研发。tRNA(转运RNA)是 mRNA 翻译过程中的 “货车”,此前并未被产学研界关注,它可以 “读出” mRNA 上由三个核苷酸构成的密码子,然后将对应的氨基酸运送到核糖体上,最后这些氨基酸串联形成蛋白质。尽管这一疗法还处在探索阶段,不过已经有产业化苗头展现出来。在国外,以 ReCode、Shape Therapeutics 为代表的 tRNA 疗法公司率先布局,融资额超过了 2.4 亿美元。tRNA 疗法的发展潜力怎样?产业化发展现状如何?真正走向应用还需要解决哪些问题?
“通用型” 疗法
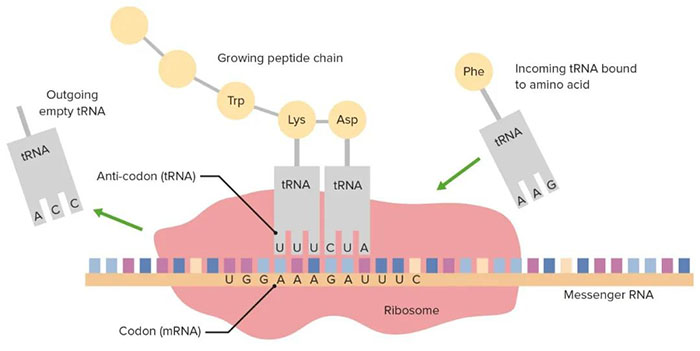
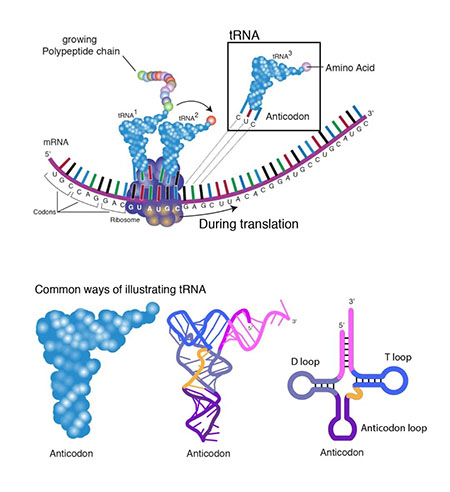
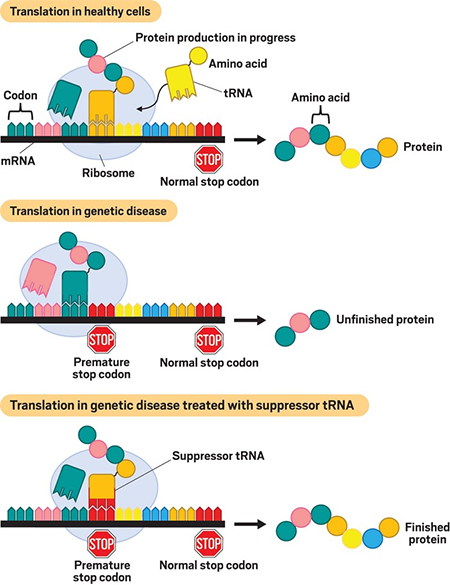
人类的遗传信息沿着中心法则的方向流动,DNA 转录为 mRNA,mRNA 翻译为蛋白质。这三类分子也成为行业研究疾病治疗的锚点。传统的治疗方法一直都是针对蛋白质,通过小分子药物修饰调节蛋白质功能;抗体疗法逐渐扩大了可药用蛋白质靶标,但同样仅限于靶向蛋白质。随着 CRISPR 的发展,基因治疗和基因编辑受到了更多的关注,不过基因编辑是在编辑基因,而tRNA则是直接编辑蛋白质。随着投资者们越来越关注基因治疗和基因编辑的局限性, tRNA 脱颖而出。tRNA 呈三叶草结构,作用于翻译过程。包括与密码子匹配的反密码子,以及携带氨基酸的 3‘端,翻译的过程中,tRNA 可借由自身的反密码子识别 mRNA 上的密码子,将该密码子对应的氨基酸转运至核糖体合成中的多肽链上。整个过程会沿着 mRNA 链进行,直到核糖体遇到终止密码子。但在某些情况下,基因突变会导致 tRNA 带入错误的氨基酸,或者突变后引入终止密码子,使翻译过早终止,生成功能不全的蛋白质。超过 11% 的遗传病就是因为密码子提前终止造成的,包括某些类型的囊性纤维化和杜氏肌营养不良症。目前,少数生物技术公司正在开发所谓的抑制性 tRNA 分子,通过设计 tRNA 的反密码子,以识别和抑制终止密码子 UGA、UAA 或 UAG。抑制性 tRNA 存在广泛,无论在植物细胞还是动物细胞中,都发现了抑制性 tRNA。但由于抑制性 tRNA 在细胞中含量极少,因此抑制性 tRNA 不易被检测到。抑制性 tRNA 由正常编码氨基酸 tRNA 反密码子环碱基突变产生,突变后的 tRNA 能识别终止密码子并与终止密码子完全互补配对,同时仍能携带氨基酸,能够在提前终止密码子处插入特定氨基酸,通读 mRNA。同时,经过设计的抑制 tRNA 仍旧可以被细胞内的翻译机器识别,包括氨酰 - tRNA 合成酶等。例如,密码子 CGA 指示 tRNA 将氨基酸精氨酸转移到核糖体。一种常见的基因突变将 CGA 转化为 UGA,将精氨酸密码子转变为过早的终止密码子。通过设计与 UGA 结合并将精氨酸转移到核糖体的抑制性 tRNA,以生成正常功能的蛋白质。图 | 抑制性 tRNA 使突变的 mRNA 正常通读同样的抑制性 tRNA 也可以用于其他应用。“任何精氨酸到 UGA 的突变都可以被这些 tRNA 逆转,” 开发 tRNA 疗法的公司 Tavard Biosciences 的联合创始人 Harvey Lodish 表示。对于投资人来说,这也是开发抑制性 tRNA 公司的一个卖点:与基因治疗和基因编辑不同,基因治疗和基因编辑必须针对特定基因和特定疾病进行设计,而 tRNA 疗法理论上对同类型的提前终止密码子导致的疾病都有效。
4 家公司初露头角
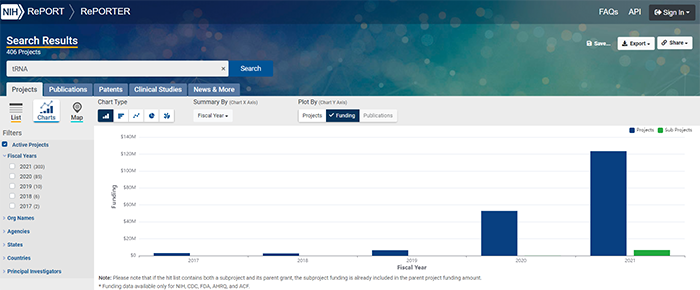
基因工程技术用于治疗遗传病的想法已经存在了近 40 年,在这之前,抑制 tRNA 疗法并没有得到学术界的重视,自然也没有吸引到资本市场的关注,大量资金涌入了以替换和改造 DNA 为主的基因疗法和基因编辑疗法上。基因疗法和基因编辑在基因疾病治疗上取得了一些进展,未来也很有潜力取得重大突破。不过目前,仍有两大难题待解,这种局限性限制了其进一步的发展。在这个过程中,有少数公司试图以一种新的路径来摆脱现在的思维方式。“这两种技术(基因疗法和基因编辑)都不是灵丹妙药,”Tevard Biosciences 的 CEO Daniel Fischer 说。Fischer 创办这家公司起初是为了治疗他女儿的 Dravet 综合症,这是一种罕见的、灾难性且终身存在的罕见癫痫性脑病,由一种钠离子通道的基因 SCN1A 故障引起。在尝试过基因疗法和基因编辑之后但无效后,他在 2017 年和几位大牛共同创办了这家公司,科学顾问包括刘如谦教授。他拿 Dravet 综合症举例说,SCN1A 的调控受到严格的控制,合成蛋白质过多或者过少都很危险。即使这个平衡问题可以解决,但是递送仍然是一个巨大且不可躲避的挑战。基因疗法和基因编辑都有包装大小的限制,并且承担了对 DNA 永久改变的风险。目前,Tevard 正在尝试开发一种名为 Tristop 的疗法,试图至少治疗三分之二的由于密码子过早终止而引起的杜氏肌营养不良。目前这一想法正在测试中,同时这家公司也正在和一些专注于肌肉萎缩症的大公司谈合作。同时,Tevard 也在尝试一种 “加强版” 的 tRNA 疗法,尝试产生双倍的蛋白质。这一技术也正在和癫痫药物公司合作。“当我告诉我们的一个投资者时,他们的眼睛亮了起来。”ReCode Therapeutics 的 CEO David Lockhart 说,“原则上来说,一旦我们用 tRNA 治疗一种疾病的方法获批准,同样的 tRNA 也可以用于其他同样具有相同突变类型的疾病。”ReCode 是一家成立于 2015 年的公司,被 MPM 和奥博资本押注。公司主要利用 LNP 递送技术开发一系列创新疗法,靶向肝脏以外的器官和组织,公司的管线包括遗传性的呼吸道疾病,比如囊性纤维化和原发性纤毛运动障碍。Shape Therapeutics 的研究负责人 David Huss 也表达了和 Fischer 一样的观点,“CRISPR 并不是万能的”“我们需要更加开放地寻找可能对每种疾病最有效的方法。”Shape 成立于 2018 年,公司主要基于 Prashant Mali 团队的研究成果。图 | ReCode 的成立基于 Prashant Mali 团队在 2017 年发表的研究,他们建立了体内 RNA 靶向的方法 tRiAD,这种方法稳定、基因组上无疤痕,并且可能无免疫原性(来源:bioRxiv)基因治疗和基因编辑的潜在局限性目前暂无最优解,在此背景下,投资者也开始寻找下一个潜力和竞争力的技术以开辟下一个利基市场。tRNA 或许会是 RNA 领域的下一个热门。ReCode 的投资方之一 Cystic Fibrosis Foundation 的 CSO 评价说,这是一个前所未有的令人兴奋的新途径,而且是开创性的。类似于 Tevard、ReCode、Shape 这样的公司,目前公开可查的并不多,主要集中在美国。不过,在 NIH(美国国立卫生研究院) 以 “tRNA” 为关键词进行搜索,在 2020 年的项目数量和项目金额都达到了高峰。图 | 在 NIH 中查询 tRNA 相关的项目,可以看到在 2021 年的项目数量远超前四年项目的总和(来源:NIH)
仍有多个难题待解
最近,产业界也逐渐开始真正认识到 tRNA 的潜力,多家 tRNA 初创公司相继浮出水面。一方面,tRNA 结构中存在假尿苷,不会引发机体过度的免疫应答,安全性更高;另一方面,据最近的研究发现,现在超过 10% 的遗传疾病是由于引发细胞无法翻译成完整蛋白质的突变造成,抑制 tRNA 功能能够改变这种有害突变,并恢复机体生成正常蛋白质的功能。不过,tRNA 疗法要真正应用于临床病人身上,还有许多问题有待研究和解决。长久以来,安全问题一直是抑制性 tRNA 疗法开发的一大障碍。科学家们无法确定抑制性 tRNA 是否只与其指定靶点相互作用 —— 即过早终止密码子,也无法确定它们是否也可能会与正常终止密码子结合;在产业化过程中,生物技术公司也无法保证生产的抑制性 tRNA 疗法的安全性,或许只有临床试验才能证明这一点。针对这一问题,德国汉堡大学 tRNA 科学家 Zoya Ignatova 提出了一种解决方案,即改变 tRNA 反密码子环的大小,使 tRNA 分子可以优先结合过早终止密码子。她还指出,修饰 tRNA 结构的其他部分也有助于使 tRNA 分子更适合成药。北京大学夏青团队通过改变识别相应 tRNA 反密码子环碱基,构建了 19 种无义突变抑制性 tRNA(无义突变是指编码氨基酸的密码子突变为终止密码子,导致肽链合成中断)。这类抑制性 tRNA 携带对应氨基酸并与提前终止密码子完全互补配对,通读无义突变,恢复提前终止密码子疾病中致病蛋白表达,并通过比较获得通读无义突变效率最高的抑制性 tRNA。安全性并非抑制性 tRNA 疗法唯一的挑战,递送也是其始终绕不过去的一道 “坎”。在培养皿中让 tRNA 分子发挥作用很简单,但是如果让足量功能性 tRNA 在体内同样发挥作用就是两码事了。现在,绝大部分公司选择递送 tRNA 的方式有两种,一是利用 LNP 包裹 tRNA 分子递送,二是将生成 tRNA 的遗传指令编码在病毒载体中。这两种系统各有千秋,具体选择要根据精准靶向递送 tRNA 的部位决定。比如说,病毒载体递送的基因片段较小,但是转染效率高;LNP 对基因编辑工具的大小没有限制,但转染率和特异性较低。可能会被其他更成熟的技术所取代是 tRNA 面临的又一难题。纠正突变的方式有很多,tRNA 并非唯一一种。比如说,Shape 正在开发一种 RNA 编辑技术以纠正 mRNA 中的突变,其已与罗氏敲定了近 30 亿美元的合作;而 ReCode 则通过 LNP 包裹着 mRNA 疗法去替换囊性纤维化中的受损基因。https://www.nature.com/articles/s41467-019-08329-4https://patents.google.com/patent/WO2017152809A1/zh