近日,据国家药品监督管理局药品审评中心(CDE)官网显示,杭州嘉因生物自主研发的基因疗法“EXG001-307注射液”临床试验申请获得批准,适应症为I型脊髓型肌萎缩症(SMA I型),伴有存活运动神经元1(SMN1)基因的双等位基因突变(缺失)。值得一提的是,这是国内首款针对I型SMA患者自主研发的基因疗法,有望填空国内此类疗法的空白。

EXG001-307是一款适用于1型脊髓性肌萎缩症(SMA I型)的新型 AAV 基因治疗药物。
据悉,其与诺华公司已上市的 SMA 基因疗法 Zolgensma 的作用机制和用法均相似,是一种新型的治疗1型SMA的基因替代疗法,有望实现一次给药长期有效。
嘉因生物表示,在EXG001-307的开发过程中,公司采用了创新设计,旨在降低基因疗法带来的对于患儿心脏及肝脏的副作用,更好的发挥基因治疗的效果,临床前动物研究结果也证实了EXG001-307的创新设计的理念。
脊髓性肌萎缩症(SMA)
脊髓性肌萎缩症(Spinal muscular atrophy,SMA)是导致两岁以下婴幼儿死亡的头号遗传性疾病,是一种常染色体隐性遗传的神经退行性疾病,由 SMN1 基因突变引起,导致脑干和脊髓运动神经元内 SMN 蛋白缺乏。
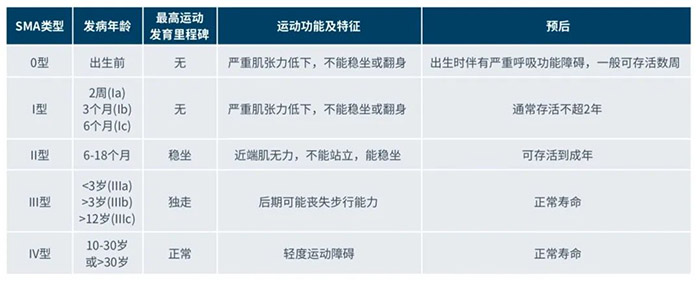
其中,1 型 SMA(即 SMA 1 型)是临床上(除极度罕见的 0 型)病情最严重的临床分型,预期只有约 8%的患者能够存活至20个月以上。患儿出生后6个月内迅速出现运动功能退化、对称性四肢无力、头控能力较差、无法达到与正常发育相对称的运动功能。其典型特征是无法实现独坐、需要依靠推车或轮椅、吞咽和喂食困难、可能由于误吸(将分泌物或食物吸入肺内)引起窒息,还可能需要借助饲管摄取流质食物来补充营养,患儿易患吸入性肺炎,多数患儿在 2 岁内死于呼吸衰竭。
SMA治疗药物
截止目前,国内尚未有适用于 SMA 患者的基因治疗药物获批上市。全球范围内,仅有三种治疗 SMA 的药物获得美国 FDA 批准上市,分别为诺华的基因治疗药物 Zolgensma、渤健的反义寡核苷酸(ASO)药物诺西那生钠 Spinraza 以及罗氏的小分子药物利司扑兰 Risdiplam。
Zolgensma 是通过静脉给药的基因治疗药物,一次注射,长期有效;Spinraza 通过鞘内注射给药(腰椎穿刺),需要重复及长期给药;Risdiplam 为口服用药,同样需要长期给药。
其中,Zolgensma 是 FDA 批准用于治疗 SMA 的第一个也是唯一一个基因疗法。此基因疗法用 scAAV9 载体经静脉输注将正常 SMN1 基因导入患者体内,产生正常的 SMN1 蛋白,从而改善运动神经元等受累细胞的功能。
截至2020年6月的长期随访临床数据显示,Zolgensma 最早一批治疗的13个患者均如期进行随访,13名患者随访时间中位时间为5.2年(范围4.6-6.2年)。高剂量队列中的10名患者100%存活,且无需永久通气。所有10名接受高剂量且接受长期随访的患者保持了先前获得的运动里程碑,并在长期随访中没有继续恶化。两名患者在不使用护理人员的情况下达到了“辅助站立”的新里程碑。
上述数据也说明,对接受Zolgensma治疗的1型SMA患者进行的持续临床随访的结果支持其长期良好的安全性,并为治疗剂量的持续临床持久性提供了证据。
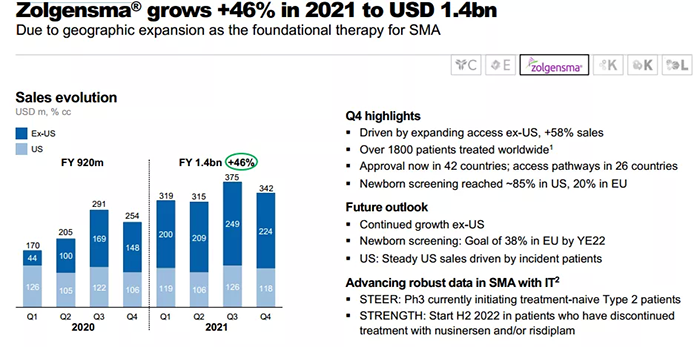
但是 Zolgensma 市售价格极其昂贵(212.5万美元,约合人民币1488万),被称为“史上最贵药物“,且尚未在中国上市。故对于中国患者而言,仍然没有可及性。2021年该疗法销售收入达到13.51亿美元,同比增长47%。
另外,Spinraza 和 Risdiplam 价格也不便宜:Spinraza 在国内最初定价接近70万一支,2021年纳入医保后,价格降至3.3万元/支,首年需要注射6次,将近20万一年;Risdiplam 在国内定价为6.38万元(60mg/瓶)。













