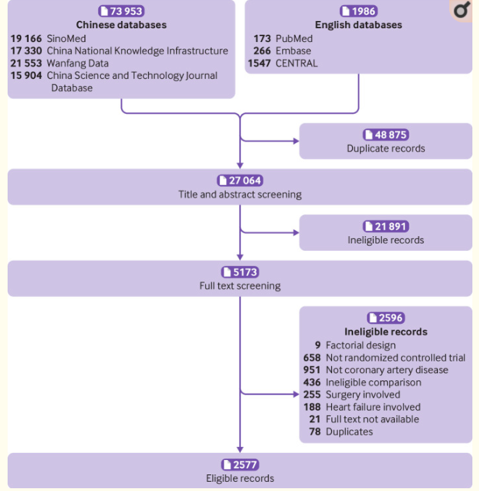
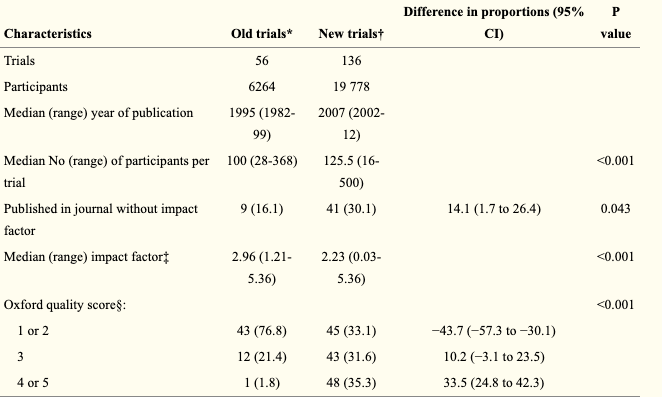
如果一种药物已被专家共识、诊疗指南推荐有效,但直到现在仍然拿病人做大大小小的临床试验,无数论文自此脱胎而出,这荒诞吗?就在今年春节前夕,由约翰·霍普金斯大学医学院和公共卫生学院发表在 The British Medical Journal(the BMJ)的一项研究引爆整个医疗界。该研究称,尽管在 2007 年中华医学会心血管分会就已发布指南,推荐他汀类药物作为冠心病的一线用药。但在之后的 11 年间(2008~2019),我国科研机构仍发表了 2000 多项「研究」 他汀类药物对冠心病疗效的临床试验,涉及约 25 万冠心病患者。作者通过搜索中英文论文数据库,从 7 万多篇论文里初筛出 5000 多篇文献,最后得到 2577 篇符合临床研究需求的相关论文。在这 2577 条记录中,作者根据是否还在招募病人的原则进一步确定有 2045 项为冗余的临床试验。站在指南的肩膀上,这些实验的的结论均大同小异:肯定该药物的疗效,值得医院推广。但它们的对照组却命运多舛。据作者统计,这些实验中有 101486 名对照组病人没有得到他汀类药物治疗,3470 名患者发生了主要心血管事件(MACEs)。其中包括 1197 名复发或恶化的心绞痛,973 例新发或复发性心肌梗塞,398名心力衰竭等重危型病变。甚至还造成了 559 例死亡。换句话说,如果能够给与对照组病人以他汀治疗,这些心血管事件,包括这 559 例死亡本该是可以避免的。除此之外,该文还发现 2000 多篇论文中大部分都以替代终点 (surrogate outcomes)作为研究终点,作者怀疑是为了缩短随访时间以快速发表。这些论文最终大都发表中文期刊,且没有任何一项在正规的临床试验注册系统登记注册过。且仅有 13% 的试验注明了已获得伦理委员会批准。该文章的第一作者,贾元熙博士告诉丁香园,他汀治疗冠心病的疗效早已经明确,且有指南推荐。但这样的冗余研究,剥夺了患者接受他汀治疗的权力,不仅是对科研资源的极大浪费、对临床诊疗也毫无贡献。且严重违反医学伦理,对病人造成了严重的伤害。一名心内科医生也表示,「冠心病的患者没有及时降血脂可能会导致严重的临床后果,包括死亡。」BMJ 的这篇论文,一石激起千层浪。实际上他汀类药物的冗余试验只是露出的冰山一角。实际上冗余试验遍布世界各地,在临床科研的各个角落中也早有爆出。2014 年, BMJ 的一篇文献发现,前人的系统性评价似乎不能提供很好的指导,很多后续多年的临床试验依然在前人提出的建议和经验前原地踏步。在临床上,静脉内使用麻醉剂丙泊酚异可能会使患者在注射部位感到疼痛。2000 年,麻醉学家 Picard 为测试预防丙泊酚注射所致疼痛的干预措施的镇痛效果,对包括 56 项随机对照试验的 6264 例患者的数据进行系统化综述。该系统评价发表在顶级麻醉学期刊 Anesth Analg 上。文献中作者得出最佳干预措施为静脉注射 40 mg 利多卡因,然后再向同一静脉内注射丙泊酚。作者也对今后的试验开展提供了建议,强调需要更多儿童的相关数据,且应该补充该领域的双盲实验。14 年后,BMJ 的一篇文献对 Picard 系统评价出版后诞生的 136 项新试验进行分析。发现这些来自 30 多个国家的文献还是采用几乎未变的实验方案,在不同时间不同医院对近 2 万多患者做着大同小异的试验:「得出和十几年前相同的结论,没有儿童群体的补充,也很少看到双盲试验的开展。」该文献指出,截止到该论文见刊,Picard 的文章是预防丙泊酚引起疼痛这一细小领域中唯一一篇系统性评价。但在这 136 篇文献中,仅有 99 篇有明确引用。在这 99 篇里,也只有 15 项试验明确报告已将该评价作为选择主要参考治疗药物的参考依据。剩下的或多或少有「为引用而引用」的嫌疑。除了这些细小领域外,BMC Medical Ethics 的一篇文献发现仿制药和传统药物也是冗余试验的重灾区。文章指出,某些国家或地区往往豁免仿制药进行大规模临床试验,以获准销售。比如在诸如印度、韩国等传统医学繁多的国家,基于传统药物和临床常用药物药效的一些临床分析就冗余严重。有文献发现在《印度药理学杂志》中有 4.8 % 的文献为冗余试验,多来自传统医学药物领域。此外,2004 年韩国的冗余文献率也高达 5.9%。贾元熙告诉丁香园,这些实验他们在文章撰写时也进行过参考总结。他表示很多冗余试验往往是以「传统药物+临床常用药物」为试验组,「传统药物」为对照组,严格意义上讲这并不是一个质量很高的盲法试验选择。根据国际医学科学组织理事会和 WHO 联合签订的《涉及人类健康相关研究的国际伦理准则》,如果一个临床试验是打算「用现有证据去证明一个已有的回答」。这个实验即使设计的再精心,也缺乏社会意义,因为所研究的问题已经「在先前的研究中得到了成功解决」。同时,「无伤害原则」也是临床医疗处理的第一守则,更别说临床试验还必须遵守《赫尔辛基宣言》:「医生有责任促进和维护患者的健康、幸福和权利,包括那些参与医学研究的患者。医生应奉献其知识和良知以履行这一义务。」由此可见,无论是从伦理学角度还是科研资源浪费角度,他汀类药物冗余试验所反映的问题都堪称触目惊心。郑州大学某附属医院心内科副主任医师洛菊(化名)告诉丁香园,当她第一次看到这篇报道时也十分震惊,「没想到他汀类药物中居然能诞生这么多临床试验。」但她认为这些他汀类药物试验质量都很低,多数查不到科研立项记录和伦理委员会的批准文件,甚至有论文造假的嫌疑。洛医生同时表示,这篇文献的社会意义要远大于临床意义:即使质量再不好,这些文献也是切切实实被期刊收录并正式发表的。 从中暴露的也不仅仅是冗余文章的问题,其背后的各个环节都值得溯源较真。是否因为论文考核等压力,而催生了这些无谓的临床试验?同意录用的杂志编辑是不是也存在不负责的嫌疑,有没有可能是受期刊生存、期刊发展所驱使?明知道病人该做的治疗不做,让病人出现心血管事件的发生。这种「草菅人命」的处理究竟是真实发生事件,还是某些「论文工厂」的粗制滥造?沈阳市某基层医院心内科副主任医师汪洋(化名)也对丁香园表示,一篇研究能将基层临床科研乱象撕开面世,是件大好事。汪洋医师表示,在二甲以下的很多基层医院无论是科研立项还是伦理学批准都不如三甲医院规范清晰,很多同事做研究说白了就是各显神通、自找门路。「我们很多随机对照试验的作者只有一个或两个人,从随机分组,给病人干预措施,再到评价结果和统计分析都一人负责,严格来讲这也不太规范。」2020 后仍有很多他汀类药物临床分析见刊 知网搜索截图汪洋说,近几年来他汀类药物的临床研究仍在继续,不过这些试验的对照组设置优化很多,多是给予 5 mg 或 10 mg 的他汀类药物,设置上也进行了优化。但汪医生也表示:「继续在这上面绣花是不是也算一种冗余试验和资源的浪费呢?」不过,无论是洛医生还是汪医生均认为,这些研究结果并不能代表中国真实的医疗和科研水平。但这些冗余试验带来的影响却危害极大:这些问题有损我国医生的国际形象,因造假导致不信任的情况或已出现。我国医生从国内再到国际发表文章势必会受到极大的负面影响。贾元熙博士表示,他也很想通过这篇文章的高关注度来强调我们对临床试验更高质量、更明确清晰的管理:「随着医学的不断进步,癌症层面、基因层面的指南与系统评价也会逐步诞生。这些都是以大量质量过硬的临床试验为根基的。消除冗余试验,也是对我国医学科研自主性上的一个极大提升。」当问及贾元熙博士是否还有想法开展其他临床领域冗杂试验的分析时,他表示想法是肯定有的,但像他汀类药物这种大规模冗余试验的情况应该不多见了:「就我个人而言,我也很希望不会见到这些似曾相识的素材了」
作者:公子王孙,DXY
参考文献:
[1] https://www.bmj.com/content/372/bmj.n48[2] Ability of a meta-analysis to prevent redundant research: systematic review of studies on pain from propofol injection[3]Kannan S, Gowri S. Redundant publication: expect the unexpected. Indian J Pharmacol. 2014;46(6):663-664. doi:10.4103/0253-7613.144950[4]Kim, D., Hasford, J. Redundant trials can be prevented, if the EU clinical trial regulation is applied duly. BMC Med Ethics 21, 107 (2020). [5]Chen YL, Yang KH. Avoidable waste in the production and reporting of evidence. Lancet. 2009 Sep 5;374(9692):786.