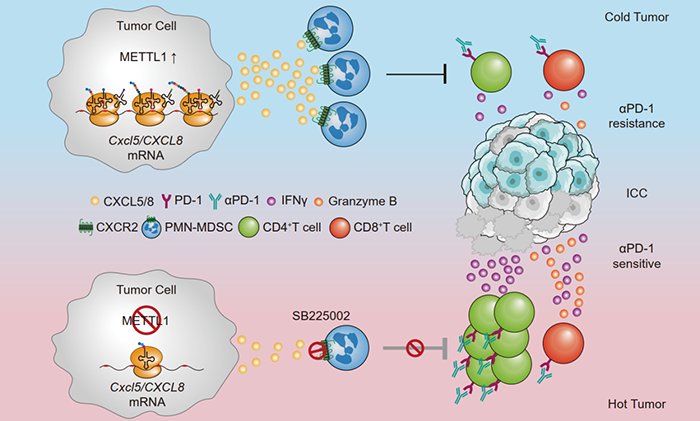
肝内胆管癌(Intrahepatic Cholangiocarcinoma, ICC)是第二大常见的肝脏肿瘤,约78%的ICC患者初诊即为晚期,因此治疗手段有限。免疫检查点抑制剂(Immune Checkpoint Inhibitor, ICI)革新了晚期肿瘤的治疗,在黑色素瘤等实体肿瘤中可产生持久的疗效。但ICC对免疫检查点抑制剂的应答率低于其他实体肿瘤。研究表明,髓源抑制性细胞(Myeloid-derived Suppressor Cells, MDSC)与ICI治疗疗效和肿瘤进展具有密切联系,然而ICC中MDSC浸润的调控机制及其对ICI治疗的疗效尚不清楚。近日,中山大学附属第一医院匡铭教授团队和林水宾教授团队在英国胃肠病学会会刊Gut上合作发表题为Targeting tumor-intrinsic N7-methylguanosine tRNA modification inhibits MDSC recruitment and improves anti-PD-1 efficacy的论文,该研究阐明了ICC中多核型髓源抑制性细胞(Polymorphonuclear MDSC, PMN-MDSC)浸润的翻译调控新机制,为改善ICC抗PD-1治疗耐药提供了联合治疗新策略。中山大学附属第一医院匡铭教授团队和林水宾教授团队发现:相较于早期ICC,晚期ICC患者的肿瘤组织浸润PMN-MDSC比例显著增加且体内阻断PMN-MDSC能够显著延缓小鼠ICC进展。生物信息学分析发现tRNA m7G修饰酶METTL1与PMN-MDSC的浸润密切相关。体内试验揭示METTL1通过促进肿瘤PMN-MDSC的浸润,抑制CD4+T和CD8+T细胞的增殖能力及抗肿瘤活性,介导ICC进展。通过tRNA还原和剪切测序以及翻译组相关技术,团队进一步发现METTL1在人和小鼠ICC中分别选择性调控趋化因子CXCL8和Cxcl5的翻译效率,从而影响PMN-MDSC的迁移能力。联合阻断趋化因子受体CXCR2并敲除METTL1可显著改善ICC抗PD-1治疗的疗效,延长小鼠的总体生存时间。该研究揭示了tRNA修饰调控免疫微环境的重要功能,发现了趋化因子在mRNA翻译层面被调控的新机制,为改善ICC抗PD-1治疗疗效提供联合新策略。该论文第一作者是中山大学附属第一医院匡铭教授的在读博士刘海宁、博士后曾雪贞和在读博士任旭鑫;中山大学附属第一医院匡铭教授和林水宾教授为共同通讯作者。匡铭教授与林水宾教授长期合作探究肝癌mRNA的异常翻译调控作用,既往研究成果揭示了mRNA异常翻译对肝癌发生发展的关键作用并于Molecular Cell等杂志发表多篇合作论文。现从免疫新视角首次揭示趋化因子在mRNA翻译层面被异常调控的新机制,为改善ICC 抗PD-1治疗疗效提供联合新策略。
文章链接:
https://gut.bmj.com/content/early/2022/10/25/gutjnl-2022-327230