
【论文题目】 A century of the phage: past, present and future
【期刊名称】 Nature Reviews Microbiology, 2015,13:777–786
【全文链接】 https://doi.org/10.1038/nrmicro3564
【第一作者】 George P. C. Salmond
【通讯作者】 George P. C. Salmond,Peter C. Fineran
【作者单位】 剑桥大学生物化学系、奥塔哥大学微生物学和免疫学系
亮 点
1、基于对噬菌体的研究,人们明确了生物的遗传物质是DNA,验证了中心法则,开创了分子生物学新领域,推动了现代生物学的发展;
2、作为地球上丰度最高的生物,噬菌体通过裂解、溶原和水平基因转移等方式影响宿主的生命周期和进化,发挥重要的生态作用;
3、对噬菌体的研究极大地促进了基因工程和分子生物学的发展,以噬菌体抗菌制剂和CRISPR–Cas系统为代表的基于噬菌体研发出的分子生物学工具正在逐渐影响人们的生活,使人们对生物学产生了颠覆性的认知,同时也产生了巨大的商业价值。
摘 要
感染细菌的病毒(即噬菌体)约100年前被发现。从那时起,人们对噬菌体的研究改变了生命科学的基础认知和相关研究。例如,噬菌体对建立分子生物学中心法则(信息从DNA传递至RNA,再传递至蛋白质)至关重要,它们在生态系统中扮演着重要角色,并促进细菌进化和产生毒性。此外,对噬菌体的研究为现代生物化学提供了许多技术和试剂:从测序和基因工程到最近发现并利用的CRISPR–Cas噬菌体抗性系统。以时间为线索,我们梳理了一个世纪以来关于噬菌体的研究,并讨论了其对基础生物学和应用生物学的影响。
在1915年和1917年,噬菌体由英国病理学家Frederick Twort和法国–加拿大双重国籍微生物学家Félix d’Hérelle分别独立发现(图1)。Twort描述了微球菌菌落的“玻璃样转化”,而d’Hérelle分离出志贺氏杆菌的“抗微生物”,并发明了术语“噬菌体”—即以细菌为食者。
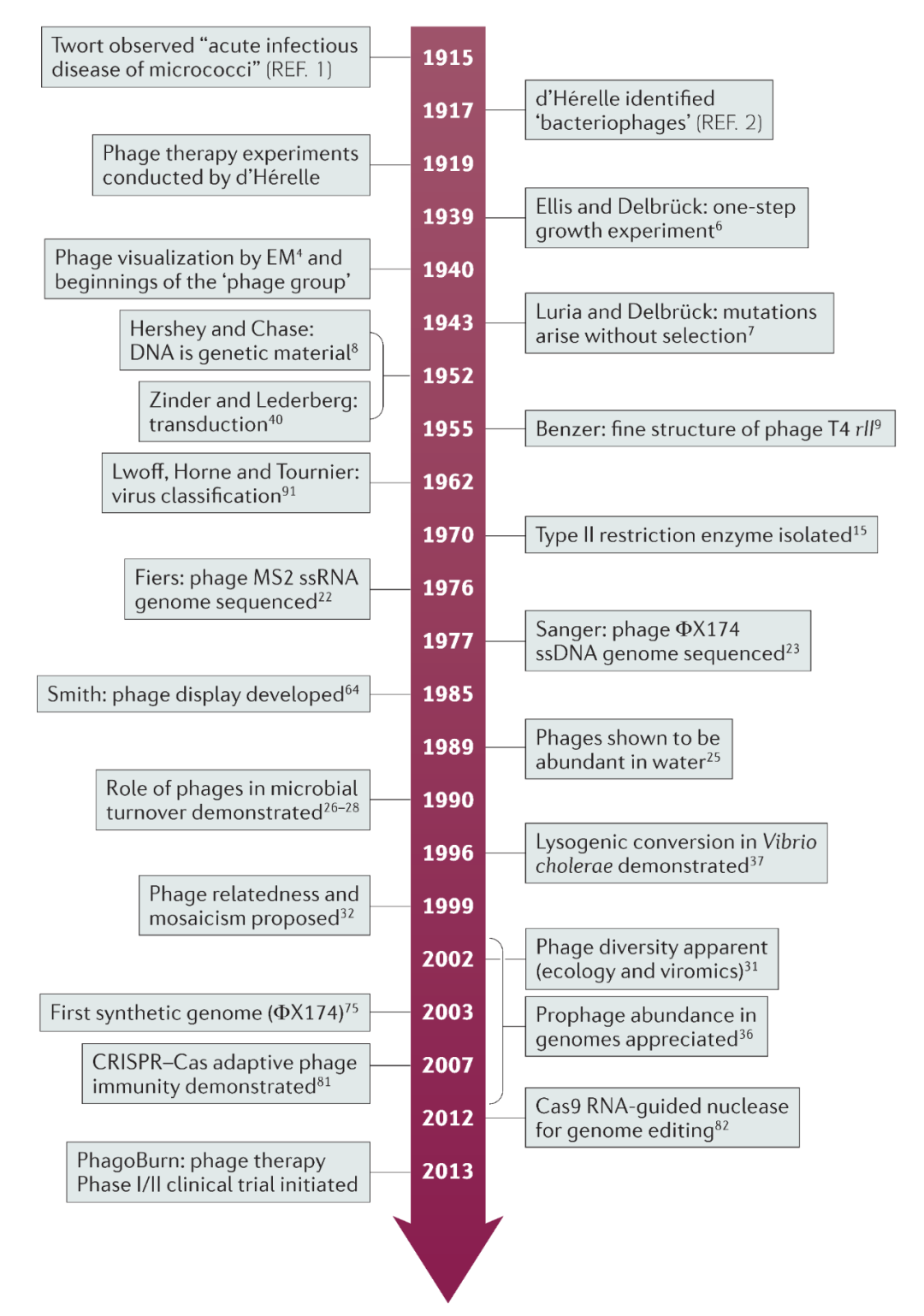
图1:百年来噬菌体研究中的一些重大事件
EM:电子显微镜;ssDNA:单链DNA;ssRNA:单链RNA。
噬菌体专门针对细菌进行细胞内寄生,并具有多种多样的生命周期(BOX 1)。d’Hérelle针对噬菌体感染细菌的能力,研究了将其应用于治疗细菌感染的潜力。甚至在他的第一篇论文中,他指出痢疾患者痊愈与体内存在噬菌体有关,他还进行了一项使用噬菌体保护兔子免受志贺氏杆菌感染的研究。早期对噬菌体的研究集中在二十世纪20–30年代,重点研究了针对细菌感染开发噬菌体疗法,甚至医药公司也开始销售噬菌体制剂。然而,在30年代末期,美国医学会药学与化学委员会认为噬菌体疗法的疗效并不明确,需要进一步深入研究。尽管前苏联和其他东欧国家有研究者在进行相关的研究,但这种担忧和抗菌化学药品(抗生素)的成功应用导致人们对噬菌体疗法的兴趣下降。在此期间,人们对噬菌体的基本生物学认识十分有限,直到40年代,噬菌体的本质是病毒这一观点还存在争议。40年代初期使用电子显微镜观察噬菌体,才确定其微观特性。
Box 1:噬菌体生命周期与分类
噬菌体的多样性非常高,目前主要通过形态学和基因组学对噬菌体进行分类。随着我们对噬菌体多样性和基因镶嵌性的了解越发深入,它们的分类也需要定期更新,这“既是一门科学,也是一门艺术”。最初,d’Hérelle认为噬菌体只能被划分到“种”水平。随后,二十世纪40年代电子显微镜技术应用使得噬菌体得以基于形态学进行分类。1962年,建立了Lwoff, Horne和Tournier(LHT)分类系统,该系统包含了核酸类型(DNA或RNA)、衣壳形态和包膜性质等方面。1966年成立了国际病毒分类委员会(ICTV),以提供一个通用的病毒分类方法。2011年,ICTV发布了第九次报告。噬菌体的遗传物质包括单链(ds)或双链(ss)的DNA或RNA,其基因组大小范围从非常简单(如MS2噬菌体的ssRNA基因组,约3.5kb)到高度复杂(如芽孢杆菌G噬菌体的dsDNA基因组,约500kb)不等,并且包括可修饰的核苷酸作为对限制酶的保护。形态学上,噬菌体可以是有尾的、多面体的、丝状的或多形的。有些还具有脂质或脂蛋白包膜。最近,ICTV的原核生物病毒小组委员会对噬菌体和古细菌病毒分类进行了相当系统化的研究。分类系统的详细信息请登录ICTV的网站查阅。特征最明显的噬菌体属于有尾噬菌体目(dsDNA基因组,形态学上有尾),被分为3个科:肌尾病毒科(如T4噬菌体)、长尾病毒科(如λ噬菌体)和短尾病毒科(如T7噬菌体)。
噬菌体可以进行裂解或溶原的生命循环(见图)。感染宿主细菌时,噬菌体首先作用于宿主细胞的受体,附着后注入其基因组。随后的复制策略取决于噬菌体是烈性的还是温和的。烈性噬菌体(如T4噬菌体)只会通过裂解循环进行复制,这一过程包括产生子代噬菌体并将其从被感染细胞中释放。而温和噬菌体(如λ噬菌体)可以进入裂解循环或与宿主稳定结合,即溶原态。在溶原过程中,病毒基因组被称为前噬菌体并与宿主DNA协同复制,或者以游离的、类似质粒的状态(如P1噬菌体),抑或整合到宿主的染色体上(如λ噬菌体)。在应激条件下,原噬菌体可以改变溶原状态,并产生更多的病毒颗粒从细菌中释放出来。通常子代噬菌体会通过溶解细胞释放到环境中,导致细菌死亡。而丝状噬菌体还通过细菌外膜分泌释放到环境中,这一方式避免了宿主死亡,但会导致慢性感染,使宿主生长速度减缓。
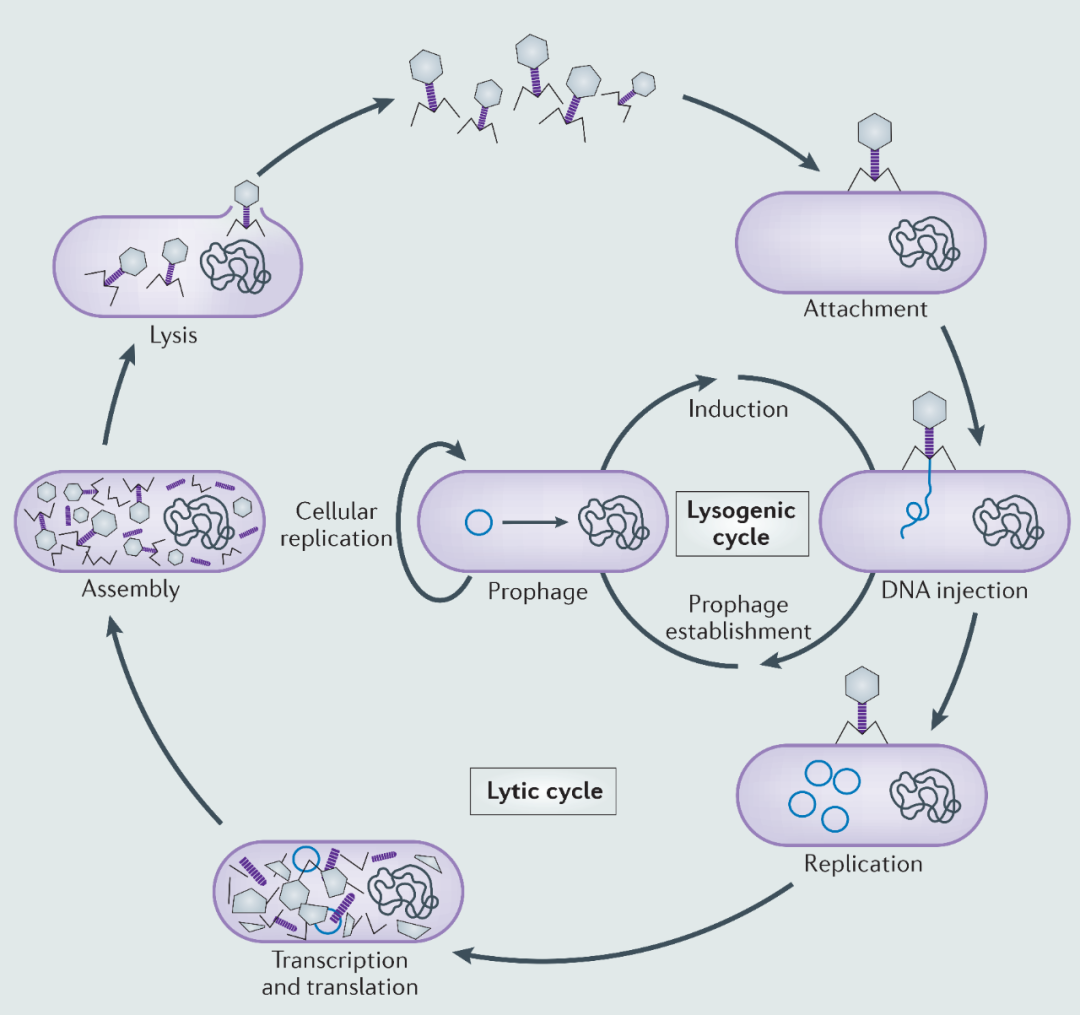
噬菌体的发现使我们对认识更广阔的生物世界有了巨大的、不可预见的影响。噬菌体“结构简单”的特性,使得我们可以了解所有生物学相关的核心生物过程。噬菌体提供了简单有效的模型系统,推动了分子生物学的发展,并提供了包括限制性内切酶在内的诸多有效的生物技术工具。此外,噬菌体对营养盐循环、致病性和细菌进化的影响突显出了其在全球生态和进化中的重要作用。而且,抗生素抗性增强,意外推动了通过噬菌体解决细菌感染疗法的发展。现在,我们还见证了基于CRISPR–Cas噬菌体防御系统开发的生物技术的惊人发展,这将彻底改变原核生物和真核生物的分子生物学研究。以时间先后为序,我们强调了自噬菌体被发现后的一百年来对分子生物学起源、对生态和进化的研究,以及对生物技术开发的影响。我们鼓励读者想象一下如果噬菌体不存在,现在的世界将是什么样子;显然,我们要感谢这种地球上丰度最高的生命体。
分子生物学的起源
生物学的关键问题
在二十世纪早期,基因的本质是生物学的核心问题。包括Leo Szilard, Salvador Luria和Max Delbrück在内的物理学家和其他研究人员开始用噬菌体作为生物模型尝试解决这个问题以及其他生物学基础问题。Delbrück鼓励研究人员使用“经过授权的噬菌体”,即T型噬菌体进行研究,以促进不同实验室研究结果之间的可比较性。T型噬菌体可以感染大肠杆菌,使其快速成为革兰氏阴性模式菌。1939年,Emory Ellis和Delbrück在“一步生长实验”中描述了噬菌体的生长,该研究揭示了噬菌体相关的如吸附、潜伏期和病毒裂解在内的关键概念。几年后,Luria和Delbrück证明突变在选择过程前就存在,进而印证了达尔文理论的猜测。这种“波动实验”包括非选择性的对大肠杆菌进行纯培养,然后进行接种,以确定细菌总量和抗T1噬菌体的细菌数量。与突变模型预测一致的是,突变体的数量发生了显著变化,这是每种培养基中出现突变体的影响因素之一。回顾之前的研究,我们现在可以根据DNA突变来解释这些实验,但在当时基因的本质并不为人所知。
通过噬菌体,Alfred Hershey和Martha Chase通过“搅拌实验”为基因本质上是由DNA组成提供了证据。噬菌体提供了理想的模型系统,因为它由蛋白质外壳和内含的DNA组成,这两者在当时被怀疑是遗传物质。他们对噬菌体的蛋白质(35S)和DNA(32P)使用放射性同位素进行标记。分别用两种不同同位素标记的T2噬菌体感染未被同位素标记的细胞,之后通过离心去除附着在细胞上的噬菌体颗粒,收集被感染的细胞。该实验证明DNA与细菌细胞有关,并确定DNA是遗传物质,因为子代噬菌体中含有32P,但不含35S。在认可了这项早期关于噬菌体的研究后,Delbrück、Hershey和Luria因发现“病毒的复制机制和基因结构”而在1969年获得了诺贝尔生理学或医学奖。在Hershey和Chase之后,Seymour Benzer通过研究T4噬菌体的rII区域分析出基因的准确结构。他通过将多个T4噬菌体rII突变体共同感染大肠杆菌来计算重组频率,从而生成rII区的高分辨率遗传图谱。Francis Crick后来也使用该系统验证支持遗传密码的三联体性质。
二十世纪50–60年代,当分子生物学提出中心法则时,人们还不知道基因如何被调节。François Jacob和Jacques Monod发现了“酶诱导”现象,该现象表明酶只有在底物存在的时候才会活化。通过大肠杆菌的lac系统,他们发现基因的转录是通过共同的阻遏蛋白调控的。尽管这些研究开发了一些噬菌体系统,但Jacob也在研究与其原理相似的λ前噬菌体诱导现象。对λ噬菌体遗传回路的进一步研究为基因调控提供了许多范例,包括鉴定DNA结合阻遏物和激活蛋白,以及转录抗终止剂。Jacob、Monod和André Lwoff因“在研究酶和病毒合成的基因调控方面的贡献”而获得1965年的诺贝尔生理学或和医学奖。这些开创性的研究,通过将分析能力与简洁明了的活体实验相结合,定义并开启了现代的“基因工程”。
分子生物学的“诞生”
早期的研究中随着对噬菌体分子生物的深入认识,发现了一些分子生物试剂,这是令人意想不到的收获。二十世纪50年代初期发现了限制–修饰(R–M)现象,这是噬菌体通过特定种类的大肠杆菌获得的非遗传变异。然而,在60年代末和70年代初,R–M系统被发现可以通过修饰(通常是通过甲基化)来保护它不被限制性内切酶切割。限制性内切酶(II型)的序列特异性促进了切割离散DNA片段技术的发展,并且T4噬菌体DNA连接酶可用于将分子连接在一起。使用这些新的基因克隆试剂,是分子生物学和生物技术行业的重大发展。Werner Arber、Daniel Nathans和Hamilton Smith因“发现了限制性内切酶并将其应用于分子遗传学”而获得1978年的诺贝尔生理学或医学奖。为了操纵和扩增DNA片段,需要克隆载体。除质粒外,噬菌体还提供了重要的克隆解决方案。λ噬菌体被开发为有效的克隆载体,对λ噬菌体的研究使粘性质粒得以发展,从而可以克隆大的DNA片段,在体外包装成噬菌体颗粒并有效地传递到大肠杆菌中。通过研究P1噬菌体衍生出的人工染色体可以用于克隆大的DNA片段。此外,通过研究基于M13噬菌体的载体,T7噬菌体DNA聚合酶提供了高质量的DNA测序解决方案。
这些进展为分离和研究基因提供了必要的工具。噬菌体技术还可以诱变细菌的基因进行功能研究。例如在随机诱变研究中,通过λ噬菌体自杀载体(进入宿主后无法复制)来运输转座子。此外,定点诱变系统来自M13和fd噬菌体。另一个例子是一种温和噬菌体—Mu噬菌体(突变体),可随机转入大肠杆菌基因组并产生突变体。这些特点已应用到各种细菌,以产生随机突变体,并与报告基因结合,将转录和翻译融合一体用于检测基因表达。
许多噬菌体衍生工具被应用于DNA测序,但噬菌体基因组同样是最早被测序的。例如,1976年Walter Fiers的研究组对MS2噬菌体基因组进行了测序,这是最早被测序的单链RNA(ssRNA)噬菌体基因组。1977年,Fred Sanger和他的研究组对ΦX174噬菌体的基因组进行了测序,这是最早被测序的单链DNA(ssDNA)噬菌体基因组。1982年,对λ噬菌体的基因组进行了测序,这是最早被测序的双链DNA(dsDNA)噬菌体基因组。通过使用限制酶、T4 DNA连接酶和M13载体对λ噬菌体进行鸟枪法测序——这几乎全都是噬菌体的衍生物。这些方法后来被应用于从大肠杆菌到人类的诸多全基因组项目。因而,不可否认的是,噬菌体对生物学的发展影响是极其深远的。
生态和进化
多样性、丰度和生态系统
噬菌体基础研究和转化研究的成功产生了巨大的影响。由于受到噬菌体衍生出的分子生物学新“工具包”的影响,许多研究人员开始关注除大肠杆菌以外的细菌和更复杂的真核生物,这些生物在遗传上易于处理。然而,从二十世纪80年代到二十一世纪的研究也重新唤醒了我们对基础噬菌体生物学的理解。人们一直认为水环境中的噬菌体数量很少,直到在1989年检测到每毫升天然水体中病毒高达2.5×108(典型范围约106—107),这表明噬菌体在微生物转化和环境中基因转移方面起着重要作用。病毒显然在食物网和海洋的碳氮循环过程中十分活跃。此外,一些海洋噬菌体的基因组含有辅助代谢基因(如编码光合蛋白的基因),这些基因被认为可以通过“补充”限制宿主代谢的功能来辅助噬菌体感染。对海洋样品的宏基因组研究,展示了噬菌体丰度和多样性的真实情况。几乎所有环境中,包括动植物相关的对噬菌体丰度和多样性的认识已经被广泛接受了。
测序技术的改进导致噬菌体基因组数据激增,进一步揭示了进化相关性和基因组镶嵌关系,对噬菌体的分类也有着重要意义。然而,尽管有着海量的噬菌体基因组数据(特别是新一代测序方法出现后),噬菌体通常编码的病毒蛋白并没有已知的同源物,并且推测这些“未知”定义了新的生物学过程。因此,我们对噬菌体及其生命周期的认识仍存在巨大空白(BOX 1)。
为了深入了解噬菌体的生态和进化作用,必须考虑它们与宿主细菌的共同进化。d’Hérelle在1917年观察到痢疾患者在康复前的粪便样本中病毒数量明显增加,这可能是对噬菌体与细菌之间相互作用的动态的早期生态学认识。在自然环境和实验室环境中的共同进化实验表明,共同进化可以促进噬菌体和细菌进化的速度,维持遗传和表型变异,并可改变微生物群落结构。的确,噬菌体和细菌构成了地球上最大的生物多样性并不为奇。在实验室中控制大型细菌和噬菌体种群的便捷性和速度,有利于将其应用于解决进化论中更普遍的问题——一种称为实验进化的方法。新一代测序技术可以阐明表型和种群转变的遗传变化,将进一步提高噬菌体-细菌系统作为生态和实验进化模型的效用。最后,CRISPR-Cas系统将宿主细菌与噬菌体联系起来的能力,无疑将促进我们对复杂生态系统中以及进化背景下它们相互作用的理解(BOX 2)。
Box 2:CRISPR–Cas适应性免疫系统
CRISPR–Cas系统为细菌和古菌提供了针对外来入侵(如质粒和噬菌体)的适应性免疫系统。然而,他们也可以参与不同的细胞过程。
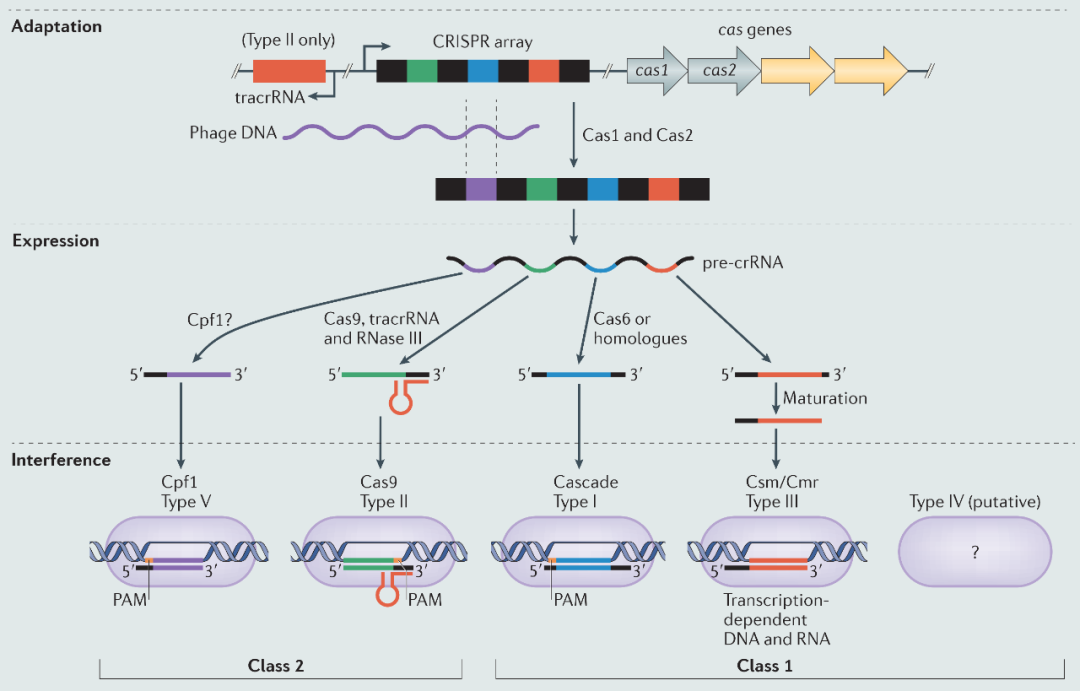
CRISPR序列由来自感染者的移动遗传组件(MGEs)的间隔序列分隔的短重复序列组成,提供了“适应性免疫”。Cas蛋白提供了抵抗入侵核酸的机制。CRISPR–Cas系统被分为两类,五个主要类型 (I–V型)和许多亚型。三种类型(I-III型)和最近的V型已经被从机理方面描述,尽管总体功能原理保守,但它们显示出显著的差异。
CRISPR–Cas系统分三个步骤工作,即适应(或获取)、表达和干扰(见图)。适应包括内切酶Cas1和Cas2,它们获得新的间隔区并将其添加到CRISPR中,并伴随着重复复制。表达阶段,cas基因和CRISPR被转录。
CRISPR全长转录本被称为前CRISPR RNA(前crRNA),并被加工成包含MGE衍生间隔序列和重复序列部分的CRIAPR RNA(crRNA)。不同系统中的crRNA是不同的。在1类(I型和III型)系统中,crRNA产生通常涉及Cas6核糖核酸内切酶。2类(II型和V型)系统中需要Cas9,宿主RNase III和非编码RNA(用于激活crRNA(tracrRNA))进行pre-crRNA处理;而在V型系统中,Cpf1会独立于tracrRNA生成crRNA。在1类系统中,crRNA形成Cas-核糖核蛋白复合物的一部分;而在2类系统中,单个蛋白质(Cas9或Cpf1)与crRNA形成复合物,Cas9也与tracrRNA形成复合物。干扰期间,这些复合物识别并降解MGE。在I型系统中,对互补DNA(原间隔区)的识别会导致Cas3的补充,从而降解入侵DNA。III型系统以转录依赖性方式靶向RNA和DNA。最后,II型和V型干扰分别导致Cas9–tracrRNA–crRNA或Cpf1–crRNA复合物降解DNA。
除了CRISPR-Cas的应用外,这些系统的生物学特性同样令人印象深刻,并揭示了噬菌体与细菌相互作用的新维度特征。例如,在被MGE“免疫”时,一些CRISPR-Cas系统优先从入侵者那里以复制依赖的方式获得新的间隔区。这限制了“自身免疫”的问题,并对攻击性复制MGE的反应增强。III型系统有另一个针对裂解噬菌体繁殖的技巧,而不是细菌基因组中的前噬菌体。然而,噬菌体可以通过点突变来破坏识别过程中的互补性,从而躲避CRISPR–Cas系统。令人惊奇的是,在被称为“激发”的过程中CRISPR–Cas系统甚至可以检测到严重变异的入侵者,并迅速获得间隔区以产生新的免疫。相对应的,一些噬菌体通过表达抑制抗性机制的抗CRISPR蛋白来应对CRISPR-Cas免疫。更复杂的是,霍乱弧菌噬菌体编码一种CRISPR-Cas系统,必须在含有抗噬菌体诱导的染色体岛(PICI)的菌株中进行复制。显然,关于CRISPR-Cas系统以及它们与噬菌体和其他MGE的进化关系,还有很多需要研究的地方。PAM,前间区序列邻近基序。
细菌的致病性与进化
根据估算,全球每秒钟大约发生2×1016次噬菌体介导的基因转移事件,这可以体现出噬菌体对细菌进化的影响(图2)。此外,在1996年发现了霍乱弧菌毒素(一种关键毒力因子)被编码在可转移丝状噬菌体CTXΦ的基因组中,这一发现突出了噬菌体在细菌致病性进化中的重要性。此过程被称为溶原性转化(或噬菌体转化),最早于二十世纪50年代观察到,它描述了前噬菌体提供有利于溶原的额外基因的情况(图2)。二十世纪90年代进一步验证了噬菌体对细菌致病性的重要性,当时基因组测序揭示了大量的噬菌体,并确定它们可以解释密切相关的细菌菌株之间产生主要遗传变异性(例如,病原体与非病原体)。例如,在化脓性链球菌中,约10%的基因组由编码多种毒力因子的噬菌体组成,而在大肠杆菌O157:H7 str. Sakai中,18种前噬菌体构成其基因组的16%。一些情况下,噬菌体为细菌提供了致病性的核心机制。例如,在产毒大肠杆菌中,噬菌体诱导上调了毒素基因,而细胞裂解对于毒素释放很重要。最后,显示同源区域的前噬菌体可以通过倒位、缺失和与其他染色体重组来驱动进化(图2)。例如,在日本分离到的化脓性链球菌M3菌株与在美国分离的菌株不同,这是因为两种不同的前噬菌体之间发生了染色体倒位,导致前噬菌体毒力基因发生重组。倒位和缺失还可以通过驱动快速进化的选择事件来调控适合度。
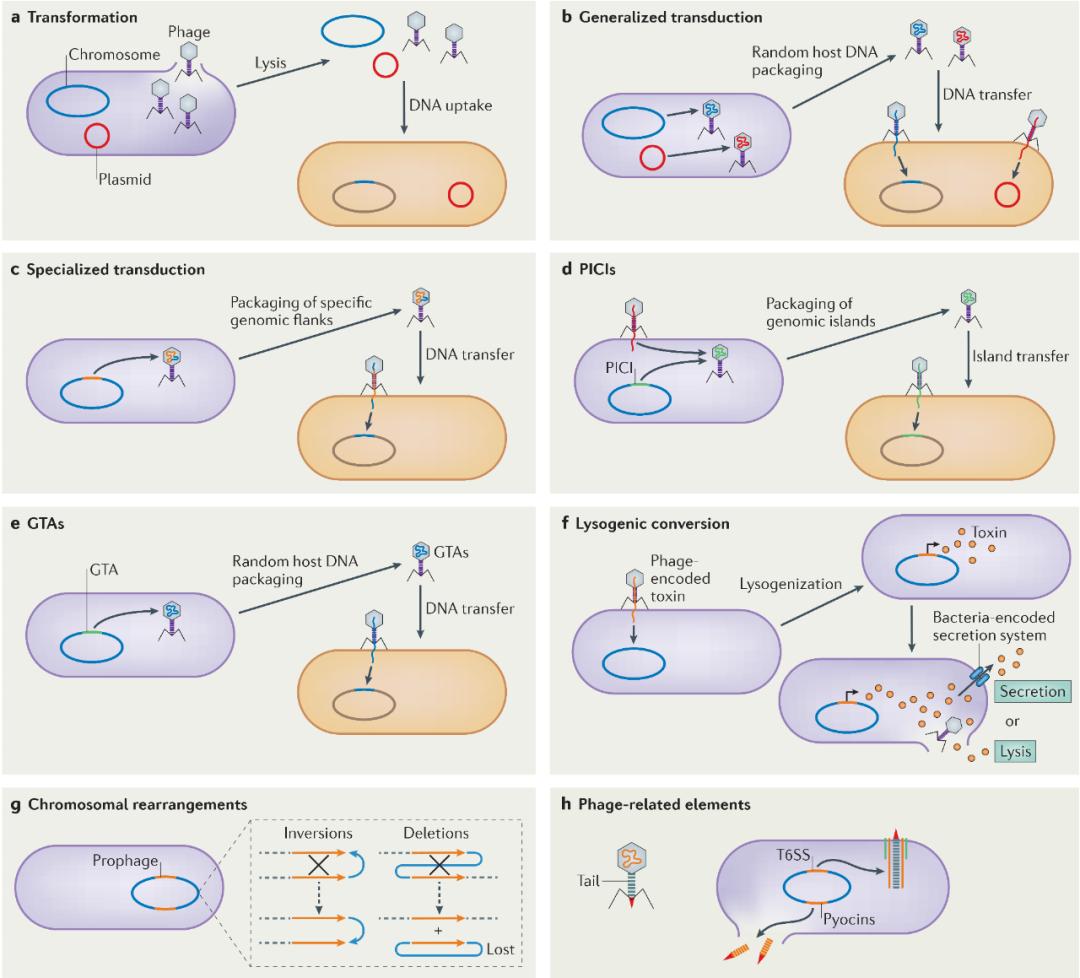
图2:噬菌体在细菌致病性和进化中的作用
噬菌体通过多种机制影响细菌的致病性和进化,包括通过水平基因转移(HGT)产生遗传多样性。
a 噬菌体介导的细胞裂解可以释放转化获得的裸露DNA;
b 噬菌体可以通过广义转导,将宿主或质粒DNA的随机片段直接注入邻近的细菌中;
c 温和噬菌体可以通过特殊的转导途径移动宿主的侧翼基因;
d 噬菌体诱导染色体岛(PICIs)可以劫持“辅助”噬菌体,实现岛的高效转导;
e 基因转移剂(GTAs)是细菌染色体上的非复制性噬菌体样单元,它包裹并转导宿主DNA,进行组成性转导;
f 在溶原过程中,温和噬菌体可以通过携带编码不同蛋白质(如细菌分泌或裂解时释放的毒素)的基因进入溶原态;
g 前噬菌体还可以通过倒位或缺失来促进重组事件,从而导致前噬菌体和基因组重排;
h 与噬菌体有关的元素(如R型腐毒素和VI型分泌系统(T6SSs),它们在结构上都与噬菌体尾部相似),是细菌武器库的一部分。
噬菌体还会影响细菌之间的水平基因转移(HGT)。例如,通过诱导细菌裂解,噬菌体促进细菌DNA释放,然后可被邻近的感受态细胞获取(图2)。此外,噬菌体通过基因转导衍生大量HGT,在这种情况下,细菌DNA在噬菌体复制过程中被意外获取,然后传递到邻近细胞中(图2)。这一现象在1952年由Norton Zinder和Joshua Lederberg发现,Joshua Lederberg因“发现关于遗传重组和细菌遗传物质组织”而获得1958年诺贝尔生理学或医学奖。特异性转导是指不精确切除后置于完整前噬菌体附近的DNA的转移(图2)。转导有助于抗生素抗性和毒力基因的转移,而抗生素暴露可促进这些过程。基因转移剂(GTAs)促进了一种“组成型广义转导”,其在细菌HGT中具有重要作用。GTAs是细菌基因组中编码的类似于前噬菌体的部分,可随机包装宿主DNA,但包装不足以实现其自身基因的传递(图2)。GTAs可能是由突变的前噬菌体进化而来,前噬菌体变得有缺陷,随后衰退。噬菌体诱导性染色体岛(PICIs)可以劫持噬菌体以协助其转移,从而产生高效转导,将这些岛转移至邻近细菌(图2)。例如,金黄色葡萄球菌致病岛(SaPIs)编码超抗原并“寄生”噬菌体以进行高频转导。由于人们对于精确识别PICIs和GTAs具有挑战性,因此它们对基因转移的贡献可能被低估了。
除了向细菌提供毒力基因外,噬菌体本身可能已在细菌R型脓菌素和VI型分泌系统的进化过程中被选择(图2)。VI型分泌系统使用噬菌体尾状细胞穿刺机制将效应蛋白递送到真核和原核细胞中。R型脓菌素类是细菌基因组中编码的近似噬菌体尾状结构,在细胞裂解过程中释放、结合并杀死其他细菌。值得注意的是,一些海洋细菌释放出一系列尾状结构,这些结构可以诱导海洋结核虫变态,这表明细菌可以利用噬菌体状结构与真核生物相互作用。总而言之,这些研究证明噬菌体可通过多种方式促进细菌的毒力和宿主之间的相互作用。
生物技术开发
噬菌体作为代用抗菌剂
最近,细菌的抗生素耐药性增强以及新型抗生素的匮乏促使农业、医药和某些食品行业重新流行起噬菌体抗菌的方法(图3)。利用噬菌体对细菌进行敏感和特异性检测也引人关注。人们正在开发多种检测方法,包括基于噬菌体诱导的裂解、噬菌体扩增、报告基因传递、细胞表面结合蛋白和生物传感器的系统。使用天然或改良噬菌体的噬菌体疗法显示出令人鼓舞的治疗效果,并且正在进行受控的临床试验。例如,用于治疗铜绿假单胞菌耳部感染的噬菌体混合物显示出明显的功效和安全性。目前,一项涉及三个欧洲国家的I/II期临床试验,正在研究噬菌体用于治疗感染大肠杆菌和铜绿假单胞菌的烧伤创面的安全性和有效性(称为PhagoBurn临床试验)。在食品安全和农业方面,噬菌体技术的应用速度越来越快,有几种批准的产品已经上市。例如用于保护加工食品免受李斯特菌侵害的LISTEX P100(荷兰Micreos)和ListShield(Intralytix;美国马里兰州巴尔的摩)。
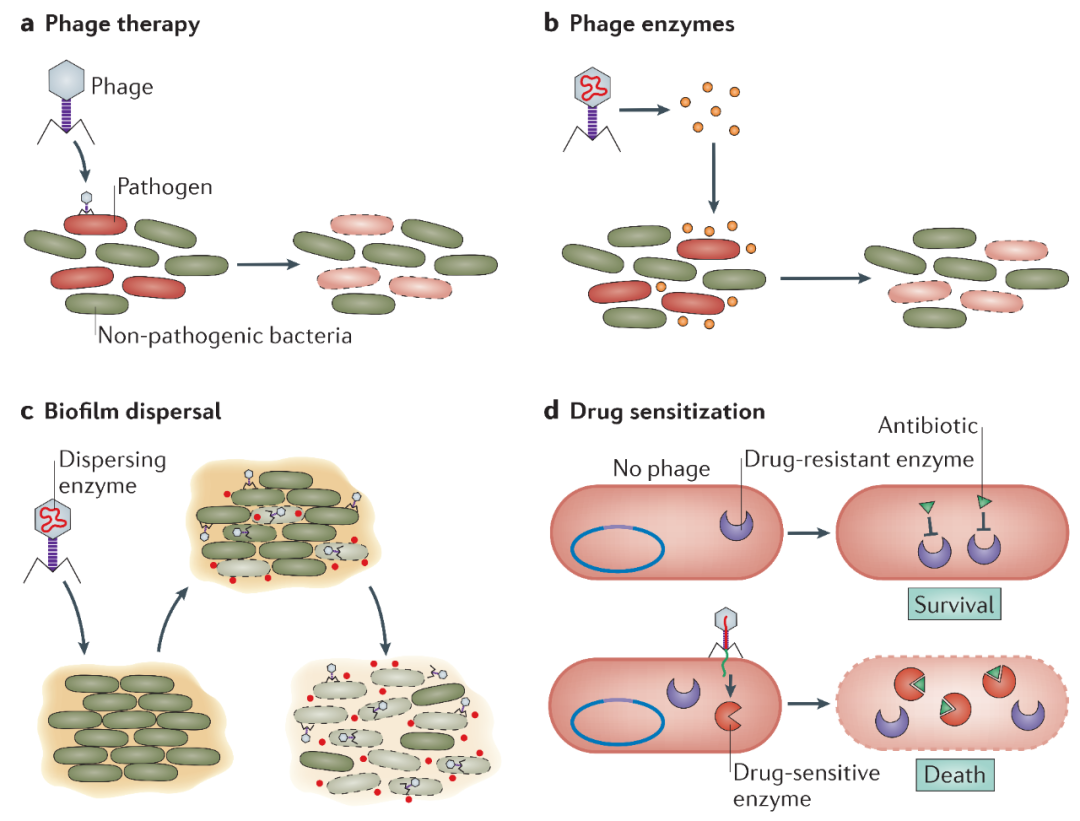
图3:一些基于噬菌体的抗菌方法
噬菌体及其产物提供了一种新的抗菌策略。
a 噬菌体的特异性可用于噬菌体治疗,通过噬菌体靶向攻击特定的细菌病原体;
b 噬菌体的产物(例如酶)可用于针对特定的细菌,包括病原体;
c 噬菌体可以通过靶向嵌入细菌中的某些结构来破坏生物膜,并且可以被设计用来释放降解生物被膜基质的特定酶;
d 噬菌体可用于敏化抗生素抗性细菌。例如,噬菌体可以将抗生素敏感基因导入耐药宿主,这种策略可以与抗生素治疗相结合。
越来越多的使用噬菌体产品或工程噬菌体的新抗菌方法正在开发中(图3)。大量研究集中在内溶素上,内溶素是在噬菌体复制过程中参与细胞裂解的肽聚糖水解酶。在革兰氏阴性细菌中,外膜还必须通过复合物(称为斯潘金斯(spanins))破坏,并融合两个膜。内溶素通常由酶活性结构域和细胞壁结合结构域组成。内溶素种类多样,大多数内溶素具有物种特异性,有些则可感染多个物种。内溶素的模块化促进了不同域的“混合和匹配”,以增加活性并改变宿主范围。通过将内溶素融合到其他结构域,可以将内溶素穿过革兰氏阴性外膜或传递到真核细胞中以靶向细胞内细菌。目前正在进行局部和静脉内使用内溶素控制人类金黄色葡萄球菌感染的I期和II期临床试验,并且已经在各种感染模型中进行了临床前试验。第一种上市的内溶素Staphefekt可用于治疗由金黄色葡萄球菌引起的人类皮肤感染。
使用内溶素的一种补充方法涉及利用尾钉或可扩散的多糖解聚酶,这可以降低如胞外多糖(EPSs)和脂多糖(LPSs)等表面聚合物的水平。去除多糖可以破坏生物膜,降低毒力并通过宿主免疫系统协助清除细菌。在此前提下,T7噬菌体被设计为在大肠杆菌生物膜感染期间表达EPS降解酶。细胞裂解释放出EPS降解酶,有助于噬菌体感染并增强抗生物膜和抗菌作用(图3)。噬菌体对其靶细菌的特异性通常被认为具有治疗优势,因为这可以限制对有益微生物的附带损害。对于可降解EPS的T7噬菌体,可通过从T3噬菌体引入基因1.2来扩展其宿主范围,从而增强其实用性,能够感染含有F质粒的大肠杆菌。还可以利用进化来选择改变的受体识别和宿主范围。例如,λ噬菌体的体外进化可以识别新孔蛋白受体外膜蛋白F(OmpF)。在自然环境中,博德特氏菌噬菌体BPP-1通过产生多样性、位点特异性、易错的逆转录来加速其尾部纤维进化,从而改变其宿主范围。噬菌体的特异性及其DNA传递效率已被用于注射致命基因的细菌,这些基因编码内切酶、胆碱、毒素-抗毒素系统的毒素或浓缩DNA的蛋白质(例如SASPject; Phico Therapeutics, Cambridge, UK)。
噬菌体还可以提高抗生素功效(图3)。例如,抗生素可以偶联到噬菌体上,使其能够传递到特定的细菌细胞,并导致局部药物浓度的增加。此外,通过使用噬菌体注射突变基因(例如rpsL和gyrA)的致敏等位基因来恢复药物功效,可以克服抗生素耐药性。另外,调控基因的传递可以以一种特定的方式重新编程细胞。例如,引入抑制应激反应的基因(例如exA),改善药物吸收(例如ompF)或抑制生物膜产生(例如csrA),都可以增加大肠杆菌的抗生素敏感性。因此,噬菌体提供了广泛的潜在方法来解决细菌感染和抗生素耐药性。但是,噬菌体工程依然面临一些需要解决的法律问题。
合成生物学与纳米技术
丝状噬菌体是对生物技术和纳米技术产生重大影响的一类噬菌体。这些噬菌体(例如M13和fd)具有小的插入物ssDNA基因组,不经分裂能够从细菌中分泌出来。George Smith首创了这一噬菌体展示技术。这种商业化的技术利用了基因型和表型之间的物理联系,并基于对大量噬菌体的筛选。不同DNA序列文库被整合到一个外壳蛋白基因上,相应的编码蛋白在病毒组装后显示在病毒颗粒表面。通常,噬菌体展示选择与特定靶点结合的蛋白质;与靶点结合的噬菌体被分离并重新增殖,而不与靶点结合的噬菌体则被冲走。噬菌体展示的方式是多种多样的。例如,纳米医学的新兴领域涉及将纳米结构用于治疗性药物的靶向传递或分子检测或诊断。通过使用噬菌体展示技术,可以将肽或整个噬菌体设计成药物、疫苗或成像标记到特定位置,或者靶向识别癌细胞或细菌感染。类似的方法正在被应用于具有对材料科学有用特性的工程噬菌体。例如,已经由丝状噬菌体构建高功率的锂离子电池,并且可以组装液晶纳米结构。
除了被工程化为有用的纳米结构外,天然噬菌体也是复杂的分子自组装纳米机器。自从首次在电子显微镜下观察噬菌体以来,许多研究小组已将X射线晶体学和电子显微镜相结合来确定高分辨率病毒结构。可视化的大多数噬菌体(约96%)是有尾巴的,属于有尾噬菌体目,分为三个科(肌尾病毒科、长尾病毒科、短尾病毒科)。肌病毒科具有直的可收缩尾巴,长尾病毒科具有柔性的非收缩尾巴,而短尾病毒科具有短的尾巴。有尾噬菌体目的结构蛋白具有相似的折叠方式,表明它们具有共同的进化历史,但是也存在相当大的形态变异。多数噬菌体衣壳为二十面体,但有些为扁长(即拉长)。有尾噬菌体目的主要衣壳蛋白具有高度保守的HK97折叠,并需要脚手架蛋白来建立合适的衣壳几何形状。空衣壳(即前衣壳)被降解支架蛋白的蛋白酶成熟,然后以能量依赖的方式通过包装复合体转运DNA,从而紧密包装线性dsDNA基因组。包装涉及大小不同的末端——一些最强大和最快的分子机器——切割基因组长度的DNA单元,并将其驱动到衣壳中。然后加入多个蛋白质堵住入口,准备头部与噬菌体尾部结合。与短尾噬菌体科(尾巴直接在门户顶点上组装)相反,肌尾噬菌体科和长尾噬菌体科独立地合成尾巴,然后将它们连接到衣壳上以完成组装。尾巴结构参与特异性受体的识别,穿透细胞膜并将病毒基因组向宿主细胞的传递。近年来,冷冻电子显微镜揭示了病毒“寻找”受体的显著方面(在噬菌体T7中发生在“随机游动”中),并揭示了DNA注射、细胞内衣壳成熟、DNA紧密包装和裂解过程中的结构重构。
噬菌体也影响了合成生物学的发展。合成生物学旨在建立具有可预测特性的“从头开始”的合成系统,噬菌体提供了新颖的分子部分和易处理的模型系统。ΦX174噬菌体是第一个完全人工合成的噬菌体基因组。噬菌体整合和重组酶催化两个序列(att位点)的位点特异性重组,其中许多包括来自噬菌体Bxb1和噬菌体ΦC31的序列,已在合成生物学和其他应用中用于驱动整合、切除和倒位过程。这些酶可以控制温和噬菌体整合进细菌基因组和从细菌基因组中切除(BOX 1)。另一个广泛使用的系统是噬菌体P1的Cre–loxP位点特异性重组系统,该系统可以以受控方式在真核生物或细菌中产生明确的遗传改变。当重组酶的表达与输入信号相连时,它们可以引起DNA序列的改变,从而生成回路,并提供可重写的遗传记忆。此外,T7 RNA聚合酶可用于设计合成回路。通过将T7 RNA聚合酶分为两个部分,这些部分可以由不同的输入独立控制,只有当两个信号都存在时,可以进行工程设计的AND逻辑门才能生成输出。因此,使用电池中的噬菌体作为记忆体进行生物计算可能不仅仅停留在科幻小说领域。
CRISPR–Cas抗性革命
在与噬菌体共同演化过程中,细菌获得了许多抗病毒策略,并且仍在演化出新的类型。这些抗性系统的基础研究产生了偶然的发现,这些发现使得强大的创新和转化应用成为可能。R–M系统是这些意想不到和无法预测的回馈的经典案例。另一种具有显著商业效益的抗药性类别是抗感染系统,通过噬菌体感染细菌的“利他细胞自杀”给予群体水平的保护。最近,CRISPR-Cas适应性免疫系统(BOX 2)的发现和表征再次证明,基本的噬菌体研究通常会产生具有广泛生物技术实用性的复杂工具。2007年首次报道了CRISPR–Cas可以提供针对噬菌体的免疫能力,仅在5年后就有可能利用这些系统进行基因组编辑。
自2012年以来,基于CRISPR–Cas系统的应用数量激增。这些研究进展集中在II型CRISPR-Cas系统(BOX 2)上,这是因为一种蛋白质(Cas9)和一种工程化单元引导RNA(sgRNA)能够引导互补DNA序列中的断裂双链。通过非同源末端连接或同源性定向修复,可以在多种生物体中产生自发或特异性突变,包括噬菌体、细菌、真菌、植物和动物。此外,一个有核缺陷的Cas9产生一个RNA引导的蛋白质,结合到特定的DNA区域来抑制基因表达,或者与激活结构融合时增强转录。进一步的发展包括建立大型的sgRNA文库,该文库可对基因功能进行全基因组筛选,以帮助药物靶标鉴定。
CRISPR–Cas9适用于模式生物和非模式生物,从而推动了基因功能的广泛研究,以及农业部门和多种生物医学应用中改良农作物和动物的发展。例如,将细胞改造为靶向HIV的药物,这会破坏潜在的病毒基因组并保护细胞免受新的病毒感染。使用CRISPR–Cas9来改变生态系统,以控制害虫物种或消灭疾病媒介,如蚊子也是当下研究热点。实际上,在实验室实验中,CRISPR–Cas9基因驱动器能够通过果蝇快速传播突变等位基因。在细菌中,CRISPR–Cas系统也可用于在多个细菌基因组中产生突变,并有可能用于合成生物学和代谢途径工程,已被视为一种新型的抗菌策略。例如,CRISPR-Cas系统可以特定序列的方式杀死细菌,选择性地消除特定菌株,选择因致病性岛丢失而毒性较低的幸存者,并通过靶向耐药基因来抑制抗生素耐药细菌。此外,CRISPR-Cas9可以用来操纵噬菌体基因组,从而更容易地和精确地研究噬菌体生物学。尽管前景看好,但这些发展也引发了许多伦理和监管问题。
结论和展望
噬菌体研究在一个世纪以来对生物学的影响是十分惊人的,其商业影响是无法估量的。如果没有噬菌体研究(例如,限制性内切酶、噬菌体展示和现在的CRISPR-Cas系统),全球生物技术业务将可能寥寥无几,一系列基于噬菌体的重要技术和潜在疗法将不复存在。除了噬菌体在帮助确定核心生物学原理方面的历史作用外,认可它们超高的教育价值也很重要。Graham Hatfull等人领导的杰出的“公众科学”(霍华德·休斯医学研究所(HHMI)—科学教育联盟(SEA)—噬菌体研究促进基因组学和进化科学(PHAGES))就是一个很好的例子。通过实用的噬菌体工作,向成千上万的大学生和高中生介绍了生物学和进化的核心原理,更重要的是,科学研究具有令人兴奋和变幻莫测的性质。这为感染单个细菌株的噬菌体产生了最大数量(>800)的基因组序列,表明我们对大约70%噬菌体基因产物功能的认识还是空白。
最近的研究还发现了“巨型”噬菌体,其基因组大于某些细菌的基因组。因此,至少在大小上,细菌和病毒之间的基因组分界可能会逐渐融合成一个遗传连续体,从而引发了关于地球生命进化本质的有趣问题。这突出了一个重要的事实,这将使噬菌体研究的新世纪变得异常激动人心。考虑到全球范围内噬菌体的绝对丰度以及我们对其大部分基因功能的完全无知,在噬菌体的基础研究中,一定还有许多未知需要我们去发掘。噬菌体感染的转录组学、蛋白质组学和代谢组学分析的新技术将揭示噬菌体新的功能和调控的复杂性。根据过去100年来的经验,这些未来的一些发现无疑将被有力地转化为医学、农业和工业生物技术。
当然,在未来几年里,我们还可以期待更多,尤其是基于噬菌体的工具的开发,这些工具可以重新用于不同的合成生物学领域。专注于一个单一的当代噬菌体研究“产品”,应该足以让我们相信令人兴奋和有影响力的未来可能性。基于CRISPR-Cas系统的技术已经使真核生物研究发生了革命性的变化,并产生了附带的伦理问题,因为它能够高保真地操纵基因组——最终可能是为了有针对性地重新设计(编辑)我们自己的基因组。人类发现了噬菌体,仅仅一个世纪,通过噬菌体就发掘了一些生物学和生物化学的秘密,取得了令人难以置信的结果。因此,也许噬菌体研究的最终生物技术可能是人类从医学治疗到进化等方面对自身基因的操控。
未来100年将揭示什么?如果一个世纪前Twort和d’Hérelle被问到过这个问题,那么他们不可能想象到我们今天所知道的一切。所以,对我们来说,噬菌体的全部潜力必然是不可预测的。重要的是,噬菌体生物学产生最大影响的应用技术(如限制性酶和CRISPR-Cas)源于好奇心驱动的对噬菌体基本现象的研究。对于基础生物科学的投入,没有比这更好的理由了。最后需要强调的是,创新发明不能仅通过优先资助低风险的战略研究的政策来产生。因此,假设继续对噬菌体基础研究进行投资,我们预计将进入令人兴奋的第二个世纪。当然,噬菌体生物学第一个世纪的研究所产生的巨大影响一定会使所有人相信这一点。













