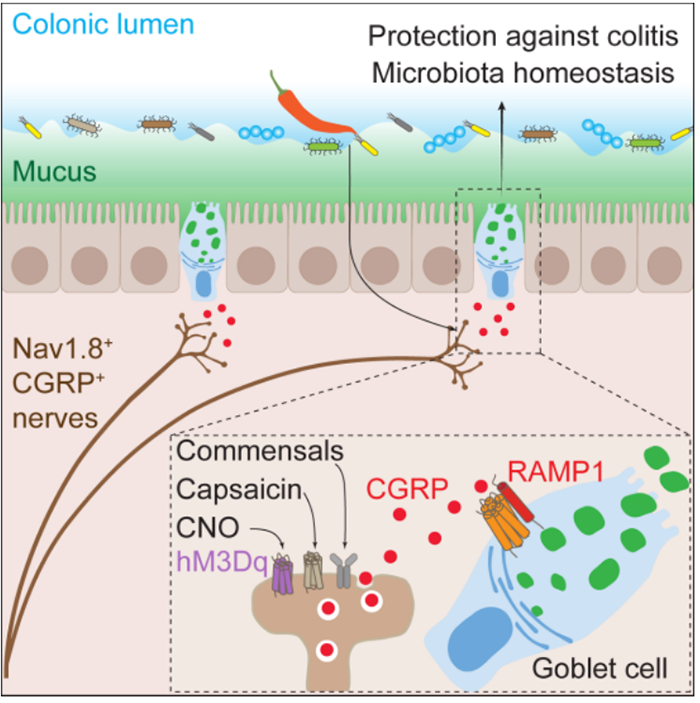
2022年10月14日,来自哈佛大学医学院的杨大平等人在Cell杂志发表了题为Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection的文章。该文章发现痛觉感受神经在肠道杯状细胞周围紧密分布,并可以促进杯状细胞粘液分泌从而保护肠道黏膜。痛觉感受神经缺失小鼠的肠道粘液层显著变薄并伴随着肠道微生态失调,而通过化学遗传学等方式激活痛觉感受神经可以使粘液层迅速变厚。痛觉感受神经可以分泌神经肽CGRP,而它的受体Ramp1在小鼠和人的肠道杯状细胞都特异性高表达。与之相对应的是,痛觉感受神经缺失小鼠以及上皮细胞Ramp1特异性缺失的小鼠都表现出肠炎易感,而无论是给予小鼠CGRP处理或者激活小鼠痛觉感受神经都可以帮助其抵抗肠炎。本研究首先构建了痛觉感受神经特异性缺失Nav1.8DTA小鼠,并用MUC2免疫荧光染色以及结肠外植体培养等手段发现结肠中的粘液层厚度明显降低。接下来作者构建了痛觉感受神经特异性DREADD(designer receptor exclusively activated by designer drugs)小鼠,它的痛觉感受神经可以被人工合成的激动剂CNO所激活,这在体外分离培养的痛觉感受神经细胞钙成像实验中得到了印证。同时,CNO体内处理后的DREADD小鼠肠道粘液层厚度迅速增加。以上结果说明痛觉感受神经很可能通过调控杯状细胞从而影响粘液层的厚度。为了探寻痛觉感受神经调控杯状细胞的机制,本研究对肠道上皮细胞进行了单细胞测序并且分析了一系列神经肽受体在杯状细胞、肠道内分泌细胞等各种上皮细胞类型的表达。分析结果发现神经肽CGRP的受体Ramp1在杯状细胞中特异性高表达,这就表明痛觉感受神经很可能通过分泌CGRP作用于杯状细胞从而调控粘液层的厚度。的确,进一步的实验表明无论是CGRP缺失还是其受体Ramp1缺失的小鼠都表现出肠道黏液层的降低。接下来的研究发现无论是肠道微生物还是辣椒素都可以促进痛觉感受神经元的激活和CGRP的分泌以及肠道黏液层厚度的增加。通过PAS/Alcian blue染色,作者发现激活的痛觉感受神经元可以促进杯状细胞中黏液囊泡的分泌并且这一过程依赖于CGRP以及其受体Ramp1。16S rDNA测序分析发现Nav1.8DTA小鼠表现出明显的肠道微生物紊乱,并且单细胞测序分析发现Nav1.8DTA小鼠其肠道上皮细胞都表现出很高的内质网应激反应,这很可能是源于杯状细胞内部粘液囊泡分泌受阻所导致的粘液层厚度降低,同时这也提示该小鼠很可能更容易遭受肠道黏膜损伤。的确,利用DSS诱导的小鼠肠炎模型,作者发现无论是痛觉感受神经元的缺失还是CGRP受体Ramp1在上皮细胞中的缺失都可以导致小鼠肠炎易感。最后,作者发现无论是人为激活痛觉感受神经还是将CGRP回输都有助于小鼠抵抗肠炎发生。本研究揭示了痛觉感受神经在调控杯状细胞细胞粘液分泌过程中的功能及其分子机制,证明了其在维持肠道黏膜稳态以及抵抗炎症中的关键作用。此外,考虑到拮抗CGRP是临床治疗偏头痛的常用治疗手段,该研究提示了长期服用CGRP拮抗剂在肠道中可能带来的副作用。同时,本研究也提供了靶向神经、靶向神经肽及其受体的以治疗肠道炎症的临床治疗思路。本文的第一作者为哈佛大学医学院的杨大平博士和Amanda Jacobson博士,通讯作者为Isaac M. Chiu教授。值得一提的是,2022年10月14日,美国康奈尔大学威尔康奈尔医学院David Artis实验室团队在Cell杂志上发表了题为Gut-innervating nociceptors regulate the intestinal microbiota to promote tissue protection的文章,揭示了痛觉感受神经元TRPV1+ 痛觉感受器通过调控肠道微生物菌群在肠道损伤和肠道炎症中起到的关键保护作用,与上述工作的了类似的结论(详见今日BioArt的单独推送)。https://www.cell.com/cell/fulltext/S0092-8674(22)01196-5https://doi.org/10.1016/j.cell.2022.09.008