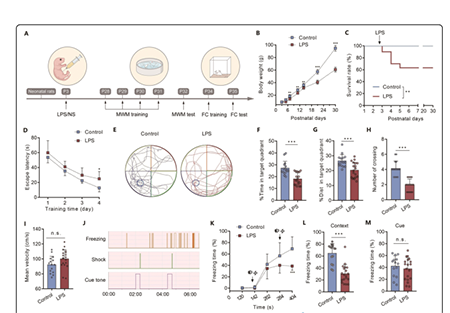
新生儿脓毒症可导致青春期或成年期的长期认知障碍,但其潜在的分子机制尚不完全清楚。K+- CL - 协同转运蛋白 2 (KCC2)的表达在出生后早期发育过程中可影响γ-氨基丁酸神经元(GABA)从去极化向超极化转变中起着关键作用。
2022年7月27日,四川大学周诚及黄瀚共同通讯在BMC Medicine(IF=11)在线发表题为“Severe inflammation in new-borns induces long-term cognitive impairment by activation of IL-1β/KCC2 signaling during early development” 的研究论文,该研究旨在确定新生儿严重炎症诱导的认知障碍是否与早期发育过程中KCC2的表达有关。
该研究发现新生儿严重炎症可导致大鼠长期认知功能障碍。同时,海马白细胞介素-1β (IL-1β)水平持续升高,直至P30注射LPS后。LPS注射后P7-P10和P14-P16大鼠CA1海马锥体神经元中KCC2和GABA反转电位(EGABA)表达升高。特异性敲除IL-1β mRNA表达后,P7-P10和P14-P16处KCC2表达升高,E-GABA过极化。特异性下调IL-1β或KCC2表达可改善新生儿严重炎症引起的认知功能障碍。总之,研究结果表明海马组织中IL-1β的持续升高可能通过KCC2的上调而引起认知功能障碍。

脓毒症是一种危及生命的综合征,由宿主对感染的异常反应导致,尤其是在新生儿中。新生儿脓毒症通常是由细菌在出生后第一个月侵入血流引起的,这是新生儿重症监护病房死亡的主要原因。世界卫生组织估计,新生儿脓毒症每年在全世界造成100万人死亡,其中42%发生在出生后第一周。近年来,随着医学的进步,新生儿脓毒症的存活率有了明显的提高。不幸的是,新生儿脓毒症幸存者发生长期认知障碍的风险增加。然而,新生儿脓毒症诱导长期认知障碍的分子机制尚不清楚。脓毒症期间,中枢神经系统(CNS)中TNF、IL-6、IL-1β等促炎细胞因子表达水平升高,被认为在脓毒症后长期认知障碍中起着关键作用。脂多糖(LPS)是一种细菌内毒素,常用于动物的全身注射,诱发炎症,重现多种并发症,如认知功能障碍,在人类新生儿脓毒症后也可观察到这种并发症。注射LPS可诱导增加促炎细胞因子,包括TNF、IL-6和IL-1β。特别是IL-1β在脓毒症后持续的神经炎症中起着关键作用,与记忆加工和长期强化以及新生儿脓毒症诱导的认知障碍密切相关。然而,IL-1β如何介导新生儿脓毒症诱导的认知功能障碍,特别是在中枢神经系统发育期间,目前尚不清楚。γ-氨基丁酸(GABA)是中枢神经系统中主要的抑制性神经递质。有趣的是,GABA介导了脊椎动物中枢神经系统各部分早期发育阶段的去极化作用,这是由于K+- CL - 协同转运蛋白 1 (KCC1) ]维持了细胞内高浓度的氯离子。GABA的去极化作用在细胞增殖和存活、迁移、分化和早期网络连接中起重要作用。近年来,新出现的证据让人们对去极化GABA信号在体内的作用有了更深入的了解。在出生后的发育过程中,通过上调K+- CL - 协同转运蛋白 2 (KCC2)介导氯离子挤压增强,GABA能激活GABA由去极化向超极化转变,这种发育变化可以作为不同神经元群体成熟阶段的指标,并与突触发育和神经元可塑性相关。KCC2除了在神经元成熟过程中设置GABA的极性外,还具有深刻的离子转运独立功能,如调节发育性凋亡,并与多种疾病有关。虽然既往研究显示IL-1β可调控CNS中KCC2的表达,但由KCC2表达改变引起的GABA异常移位是否参与新生儿脓毒症或严重炎症诱导的长期认知功能障碍尚不清楚。在此,该研究证实IL-1β水平的持续升高通过在发育过程中调节CA1海马锥体神经元中KCC2的表达影响GABA的转移,最终导致新生儿严重炎症后的长期认知障碍。新生儿严重炎症可导致青春期大鼠长期认知障碍(图源自BMC Medicine )总之,研究结果强调了在新生儿严重炎症模型中IL-1β/KCC2表达与长期认知障碍之间的机制联系,并为预防和/或治疗早期感染性炎症后的认知障碍提供了潜在的分子靶点。https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-022-02434-w