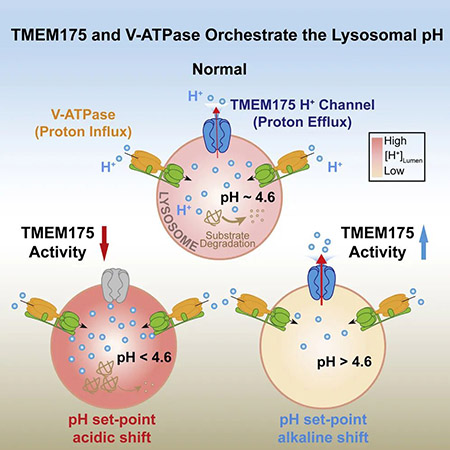
作为细胞中的“回收站”,溶酶体在细胞健康代谢中发挥着重要作用。而溶酶体内部偏酸性的 pH 环境(pH~4.6),又是保障溶酶体持续正常运转的基础。那么溶酶体内部 pH 的稳态究竟是如何维持的呢?质子泵 V-ATPase 自然居功至伟。此前,V-ATPase 复合物已经被发现可以通过一系列精妙的调节机制,实现对溶酶体内外 pH 稳态的维持。这套复杂的分子机器能够利用 ATP 水解产生的能量,源源不断地将细胞质基质中的氢离子逆浓度梯度泵入溶酶体内部,从而为溶酶体营造出一片酸性的环境。除此之外,研究者们一直认为存在未被鉴定的氢离子通道来介导氢离子快速外流,并和 V-ATPase 协同来调节溶酶体的酸碱平衡。
2022年6月23日,密歇根大学徐浩新团队(胡美钦、李平、王策为共同第一作者)在 Cell 期刊发表了题为:Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes 的研究论文。
该研究表明 TMEM175 是帕金森病(PD)的遗传风险因素,并证明了 TMEM175 是溶酶体膜上的氢离子通道,在调控溶酶体酸碱平衡的发挥重要作用,TMEM175 的突变会导致溶酶体过度酸化,蛋白水解活性受损,并促进体内α-突触核蛋白聚集,这与帕金森病发病密切相关。

这一研究的灵感来源于徐浩新教授团队很早以前的一个发现:他们在对细胞内溶酶体膜直接进行电生理记录时,只要溶酶体膜内外仿照生理条件存在 pH 差别(膜外为pH=7.2的中性环境,膜内为pH=4.6的酸性环境),就总是能够记录到特异的从膜内流向膜外的微弱电流。假如将膜内pH调整为更加酸性的3.5,这一信号会更加强烈。基于这一观测,作者大胆猜测介导该电流的离子通道即是科学家们苦苦追寻的溶酶体膜上的氢离子通道,与 V-ATPase 质子泵互相配合,一进一出,共同调节溶酶体的 pH 平衡。
为了找出这一“预测存在”的溶酶体氢离子通道蛋白,作者对一系列可能的溶酶体膜蛋白逐一进行过表达测试,最终,在排除了数十个蛋白后,发现当膜蛋白 TMEM175 被过量表达时,所记录到的“氢离子电流”竟比对照组高出了20倍之多;与此同时,利用 CRISPR-Cas9 基因编辑技术将 TMEM175 基因进行敲除后,即使设定溶酶体膜内 pH 为更酸的 3.5的情况下也记录不到任何电流信号。
这些结果表明,TMEM175 就是那个介导氢离子进出溶酶体的离子通道。可经过查阅文献作者却发现,此前围绕 TMEM175 的研究工作普遍认为这是一个钾离子通道。那么问题来了,该如何解释两者之间的差异呢?
经过对比,他们注意到两者所采用的实验条件却存在着一个本质的不同:先前文献在研究 TMEM175 时,忽略了 pH 对通道功能的调节作用,进而认为 TMEM175 主要通透的是钾离子;而这项最新研究则是在将溶酶体内部 pH 调节为更接近生理环境的酸性的条件下开展的一系列实验——他们确认:在此生理酸性条件下,通过 TMEM175 的离子主要为氢离子,而非钾离子,经过定量计算,得出 TMEM175 对氢离子的通透性是钾离子的约五万倍。
更加令人振奋的是,他们还首次鉴定出可以激活 TMEM175 通道的小分子化合物 DCPIB 和 ML 67-33。这些化合物不仅能激活通道的氢离子电流,在中性条件下也同样可以激活钾离子电流。此外他们还发现内源的脂质分子花生四烯酸(Arachidonic Acid, ArA)是 TMEM175 通道内源的激活剂,提示脂质信号通路很可能对 TMEM175 的活性存在调节作用。这些激动剂均可以特异性的激活 TMEM175 通道来释放溶酶体内的氢离子(溶酶体内pH上升),所以 TMEM175 成为可以用来调节溶酶体酸碱度的新靶点。
为了进一步探究离子通道 TMEM175 的调控机制,作者将溶酶体内部调整为中性pH、将溶酶体外部调整为酸性 pH,发现此时即使空有氢离子浓度梯度,却无法记录到氢离子电流,表明溶酶体内部的氢离子对于 TMEM175 激活必要性,即 TMEM175 可以被氢离子本身激活。
作者还观察到,虽然在过表达的情况下可以在部分细胞上记录到 TMEM175 钾电流,但是内源性的 TMEM175 却没有表现出可被记录到的钾电流,而激动剂 DCPIB 和花生四烯酸却可以激活出明显的钾电流,所以 TMEM175 并不是如之前所认为的自然开放的钾离子通道,而是一种新型的具备门控机制的氢离子通道,并在中性或碱性环境以及激动剂存在的条件下具备钾离子通透能力。
通过突变筛选,作者发现当 TMEM175 蛋白中第41个氨基酸由带负电的的天冬氨酸突变为中性的丙氨酸(记为D41A突变体)时,TMEM175 完全失去了酸性条件下通透氢离子的能力,但中性条件下通透钾离子的能力得到了保留。利用 D41A 突变体,作者得出结论:TMEM175 的氢离子的通透性,而不是钾离子的通透性,是调控溶酶体 pH 相关功能的关键所在。
近年来,研究者在帕金森综合征的病人体内普遍检测到了 TMEM175 基因的突变,由此启发作者进一步探索 TMEM175 功能更为广阔的生理学意义。
首先,在细胞水平,作者发现 TMEM175 基因敲除细胞内溶酶体的 pH 稳态被破坏,溶酶体处于一种“酸性过强”的状态,同时溶酶体内部的蛋白水解酶 Cathepsin B 和 Cathepsin D 活性受到影响。其次,动物模型中,研究者构建了 TMEM175 基因敲除小鼠,在小鼠神经元中同样观察到了溶酶体酸性过强、溶酶体降解功能受损的现象。同时,与神经退行性疾病帕金森症致病相关的α-突触核蛋白(α-Synuclein)聚积现象在 TMEM175 基因敲除小鼠中也更为显著。
综上所述,该研究开辟了溶酶体 pH 调节的新方向,首次鉴定出溶酶体膜上的氢离子通道:TMEM175 是一种新型的氢离子激活的氢离子通道。
密歇根大学安娜堡分校徐浩新教授和胡美钦博士为本文共同通讯作者,胡美钦博士、李平博士和王策博士为共同第一作者。目前,徐浩新团队已搬迁到浙江大学医学中心&良渚实验室,胡美钦博士现单位为浙江工业大学药学院、李平博士现单位为中科中山药物创新研究院。
论文链接:
https://doi.org/10.1016/j.cell.2022.05.021













