2022年6月13日,来自东京大学的Moritoshi Sato团队在Nature Biotechnology上在线发表了题为A red light–responsive photoswitch for deep tissue optogenetics的研究文章。研究人员为解决光遗传学工具的发展瓶颈和临床需求,设计基于细菌光敏色素DrBphP的红光调控激活的新工具MagRed,结合CRISPR-dCas9创建红光诱导型转录调节剂,实现对多个内源性靶基因高达378倍的转录激活;还利用MagRed调控Cre重组酶的解离与组合,可实现在哺乳动物组织深处进行光激活的DNA重组。
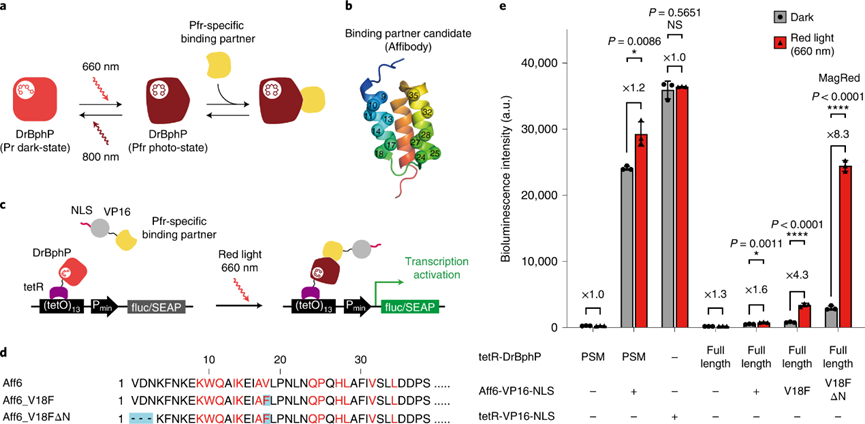
图1. MagRed的开发与表征
作者首先分析了源自D. radiodurans的细菌光敏色素DrBphP的光响应特性,DrBphP与哺乳动物内源性发色团(BV)结合后,其光感应核心模块DrBphP-PSM可在Pr暗态和Pfr光态之间发生可逆的构象转换。因此,理论上可以开发特异性结合Pfr光态的伴侣蛋白,选择性结合Pfr光态的DrBphP,而不结合Pr暗态的DrBphP。而且,在移除红光后,DrBphP从Pfr光态复原Pr暗态的速率较缓,7 分钟内衰减幅度为24%,接下来的1,291分钟内衰减幅度为76%[4],有利于保持它与伴侣蛋白的结合,具有开发为光敏工具的潜力。接着,作者使用葡萄球菌蛋白A的Z结构域的免疫球蛋白Affibody,利用第一个和第二个螺旋中的13个残基随机生成DrBphP伴侣蛋白的核糖体展示文库[5],经过筛选得到高亲和力的伴侣蛋白Aff6_V18FΔN,在红光照射下实现对报告基因达8.3倍的激活表达。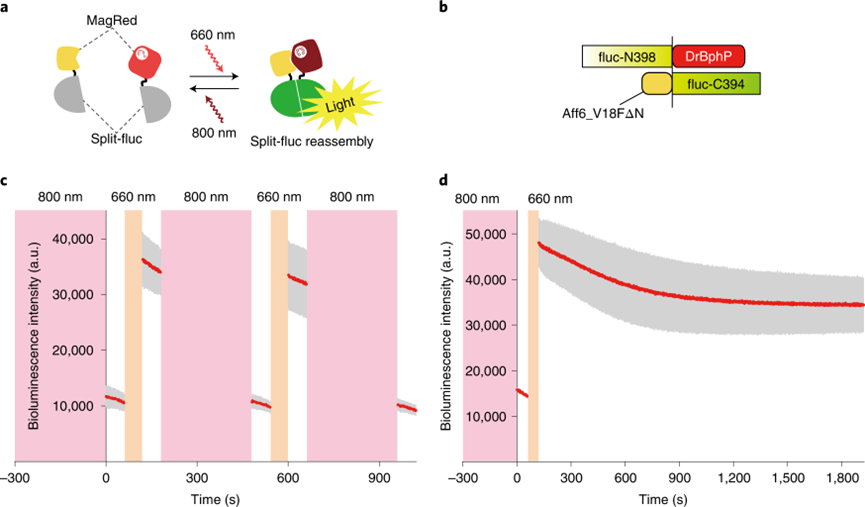
图2. MagRed的解离与结合效率
作者将DrBphP和特异性结合蛋白Aff6_V18FΔN命名为MagRed。为了进一步表征MagRed在哺乳动物细胞中的活性,作者使用分裂萤火虫荧光素酶 (split-fluc)进行了生物发光测定。对表达MagRed融合split-fluc的HEK293T细胞,使用660-nm和800-nm波长的光源进行处理,作者发现MagRed的重复结合和解离是可行的,并且不改变荧光素酶的生物发光活性。这些结果表明双色脉冲可以独立且重复地控制MagRed的结合(开启)和解离(关闭)。接着,作者测量了MagRed在活细胞中的解离动力学。撤去660-nm的处理后,MagRed融合的split-fluc在前10分钟内光强降低了21%,之后维持约70%的生物发光强度。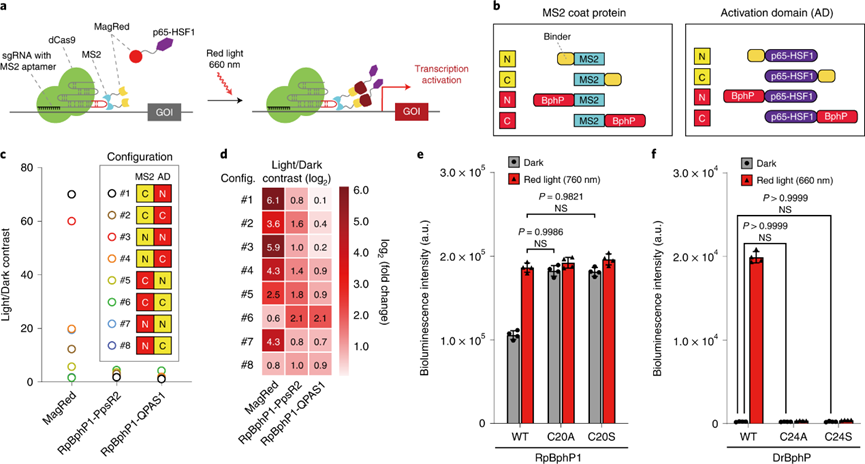
图3. 基于MagRed和dCas9的光激活转录系统Red-CPTS
为了研究MagRed的适用性,我们将 MagRed 应用于基于CRISPR–dCas9的光激活转录系统(CPTS)[6]。在该系统中,CRISPR–dCas9在sgRNA的指导下靶向基因组内的目标基因,并通过MS2适配体-MS2蛋白的特异性结合招募MagRed的DrBphP蛋白;MagRed负责在红光照射下特异性招募转录激活域p65。作者使用了之前开发的光遗传学工具RpBphP1-PpsR2/QPAS1[6]作为对照,发现基于MagRed的CPTS显示出更低的背景和更高的调控效率,可激活达70倍的靶基因转录。作者还证明了Red-CPTS可用于在活体小鼠体内诱导红光依赖的基因转录激活。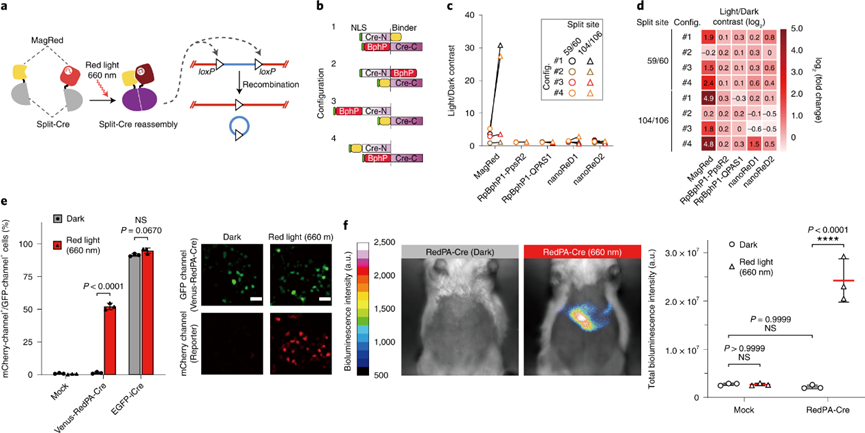
图4. 基于MagRed和Cre的光激活DNA重组系统RedPA-Cre
作者接着在小鼠上检验RedPA-Cre的适用性,通过将RedPA-Cre递送至小鼠肝脏,在其腹侧暴露于660-nm红光的照射下后,观察到其肝脏中发生DNA重组反应,诱导了显著的生物发光信号。此外,作者还观察到,带有RedPA-Cre的小鼠在黑暗中表现出很少的 DNA 重组活性。这些结果表明,即使使用外部和非侵入性红光照明,RedPA-Cre也可以有效地诱导活体小鼠内脏器官中的 DNA 重组。 综上,研究人员成功开发了一种红光激活的光遗传学工具MagRed,主要解决了该领域现有的三个问题:1)由于蓝光散射特性,造成基于蓝光激活的工具在动物水平的应用受限;2)现有红光激活工具的较大分子尺寸,不利于体内递送,以及3)依赖与外源性发色团的共价结合。该研究基于MagRed还分别开发了RedPA-Cre 和Red-CPTS,即红光可控的基因重组和转录激活的分子工具,并实现在活细胞水平和动物深层组织(肝组织)的灵活应用。
参考文献
[1] Chen, X., Chen, Y., Xin, H., Wan, T. & Ping, Y. Near-infrared optogenetic engineering of photothermal nanoCRISPR for programmable genome editing. Proc. Natl Acad. Sci. USA 117, 2395–2405 (2020).
[2] Shao, J. et al. Smartphone-controlled optogenetically engineered cells enable semiautomatic glucose homeostasis in diabetic mice. Sci. Transl. Med. 9, eaal2298 (2017).
[3] Ziegler, T. & Möglich, A. Photoreceptor engineering. Front. Mol. Biosci. 2, 30 (2015).
[4] Wagner, J. R. et al. Mutational analysis of Deinococcus radiodurans bacteriophytochrome reveals key amino acids necessary for the photochromicity and proton exchange cycle of phytochromes. J. Biol. Chem. 283, 12212–12226 (2008).
[5] Nord, K. et al. Binding proteins selected from combinatorial libraries of an α-helical bacterial receptor domain. Nat. Biotechnol. 15, 772–777 (1997).
[6] Nihongaki, Y. et al. CRISPR–Cas9-based photoactivatable transcription systems to induce neuronal differentiation. Nat. Methods 14, 963–966 (2017)













