2022年4月13日,加州大学洛杉矶分校 (UCLA) 的Juli Feigon组和周正洪组合作(刘保成博士与何垚博士为共同第一作者,其中何垚博士为两组共同培养博后)在Nature上在线发表文章 Structure of active human telomerase with telomere shelterin protein TPP1,解析了人源端粒酶与端粒蛋白TPP1的冷冻电镜结构,揭示了TPP1招募端粒酶的分子机制,对端粒酶自身内部相互作用机制进行了分析,解释了端粒酶抑制剂以及疾病相关突变的作用机理,为靶向端粒酶的药物开发提供了重要依据。

在此研究中,作者通过细胞内过表达的方法,获得了完全体的端粒酶,并解析了其3.3Å分辨率的电镜结构。该端粒酶完全体主要包含一个催化核心和一个负责端粒酶RNA合成、组装的H/ACA RNA蛋白复合体。通过外源添加TPP1 蛋白,最终获得了复合体结构并解析到3.5Å分辨率。
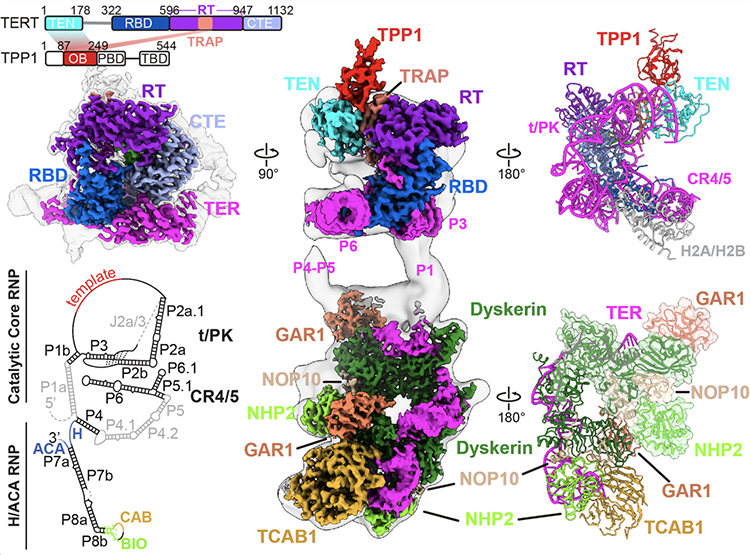
图一 人源端粒酶结构示意图
端粒酶被招募到端粒末端的过程一直是个迷。在此研究之前已有多篇相关报道,提出了TPP1蛋白在招募端粒酶中的重要作用及可能的作用位点,却一直缺乏重要的结构证据,该论文则通过高分辨率结构填补了这个空白。作者发现TPP1蛋白可以结合在端粒酶的N端结构域(TEN)和TRAP结构域,形成一个三元稳定结构。TPP1蛋白在稳定住端粒酶N端结构域的同时,实现对端粒酶活性的刺激。在结构的导向下,作者对二者的相互作用面及关键氨基酸进行了分析和探究,并用端粒酶活性测试的方法证明了这些氨基酸的关键作用,同时也解释了相关突变导致疾病的原因。
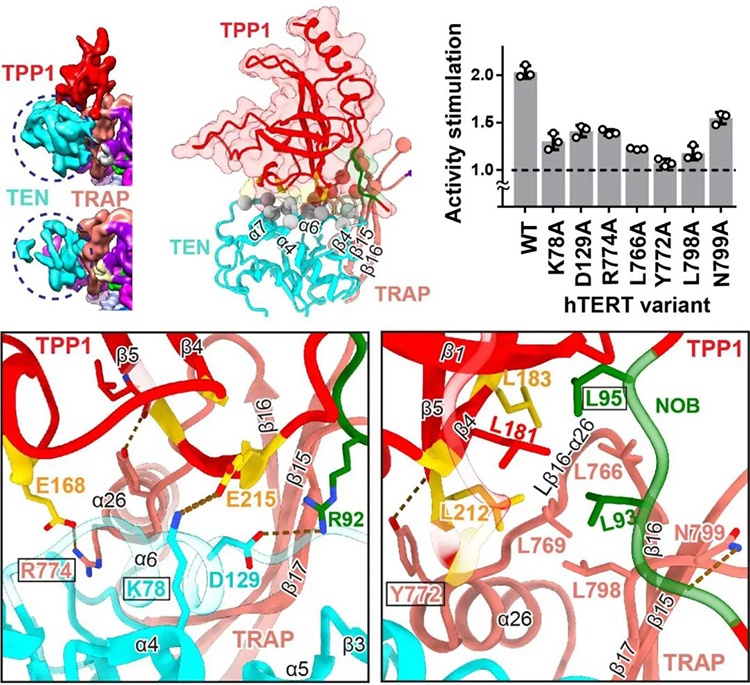
图二 TPP1蛋白与端粒酶的相互作用
在进一步的结构分析中, 作者探索了端粒酶催化核心,并通过对比之前组内研究的四膜虫端粒酶的结构,得出了二者共用类似的端粒DNA合成机制的结论。
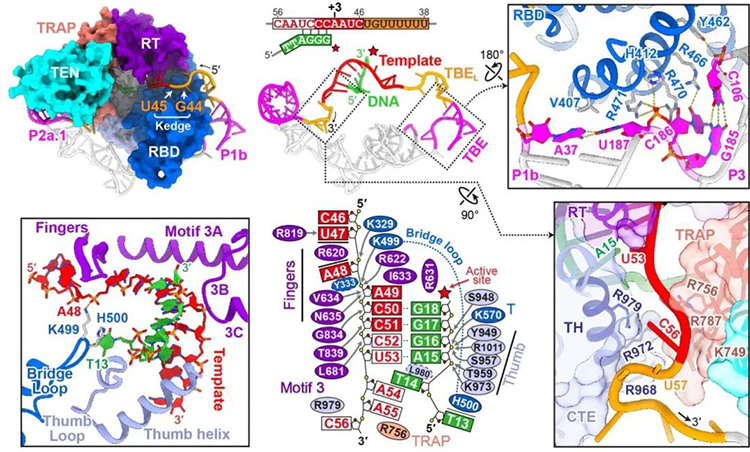
图三 端粒酶催化核心的工作机制
通过分析端粒酶催化核心组分TERT和TER的相互作用位点,作者得到了更多细节信息,端粒酶是一个蛋白质与RNA高度协调、相互作用的有机整体,任何微小的变化都可能导致端粒酶的活性异常。基于此,作者通过比对已知结构,推测出了端粒酶特异性抑制剂BIBR-1532的可能作用机理。
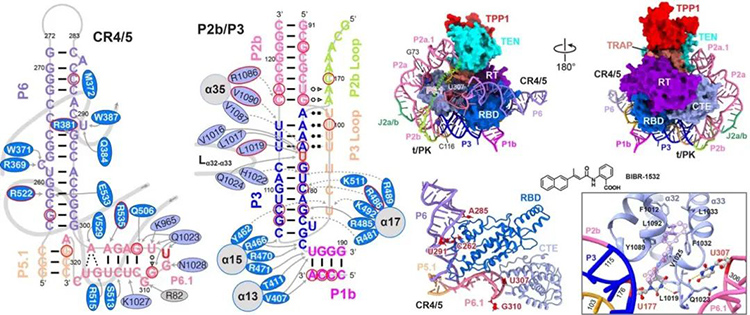
图四 端粒酶TERT与TER相互作用分析
最后,通过对比端粒酶在线数据库,https://telomerase.asu.edu/, 作者分析并汇总了数据库中端粒酶相关疾病的可能结构基础,为后续基于端粒酶的药物研发提供了重要数据支持。
原文链接:
https://www.nature.com/articles/s41586-022-04582-8













