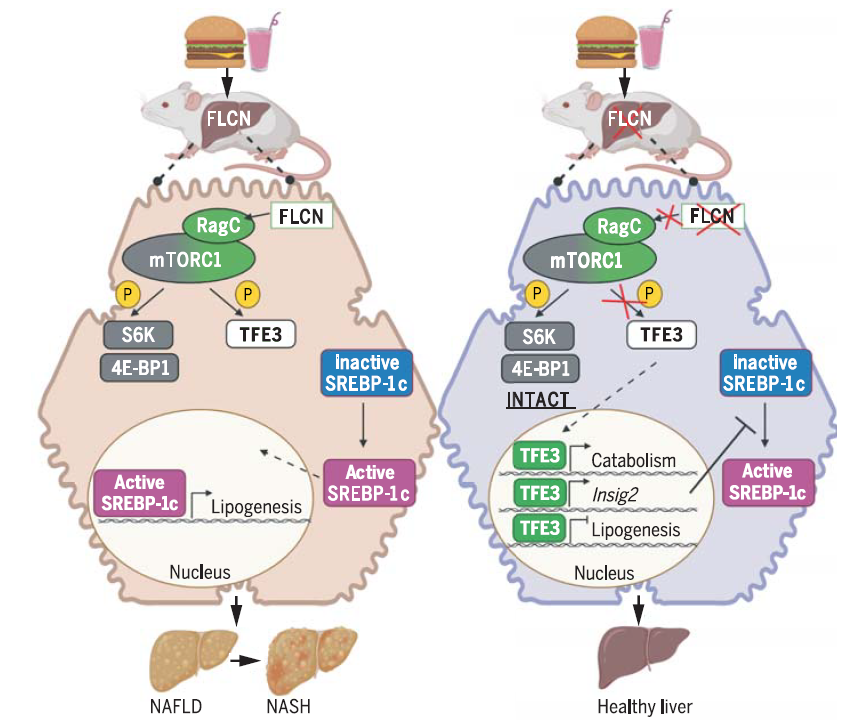
来自宾夕法尼亚大学的Zoltan Arany团队在Science 上发表题为Inhibition of nonalcoholic fatty liver disease in mice by selective inhibition of mTORC1 的文章。研究展示了通过敲除肝细胞中FLCN可特异调节TFE3的入核,激活溶酶体基因转录,保护小鼠免受高脂饮食脂肪肝的困扰,从而揭示NASH可能的新作用靶点。作者用肝脏特异性蛋白TBG启动子驱动表达Cre的嗜肝腺相关病毒AAV8感染FLCN LOX/LOX小鼠,产生肝脏特异性敲除FLCN的小鼠。检测发现敲除小鼠中肝脏细胞中FLCN,促进了TFE3在细胞核中富集;表明肝细胞中的FLCN可以激活mTORC1,并阻止了TFE3向细胞质中富集。给与小鼠正常饮食或者可以诱导NAFLD的饮食都不能明显改变flcn-/-敲除肝细胞中mTORC1经典底物S6K,4EBP-1以及Lipin磷酸化改变,进一步说明FLCN仅特异调节TFE3的入核。喂食正常食物,敲除组小鼠和对照组小鼠体重无明显区别。有趣的是,而喂食可以诱导NASH的食物时,对照组小鼠发展为肝脏脂肪变性,而大多数敲除组小鼠则受到保护。作者又使用其他两种喂食模型验证了FLCN缺失可以有效保护肝脏脂质失衡,并且这种保护作用与体重无关。FLCN对脂肪肝形成的保护作用通过TFE3实现;如果同时敲除FLCN和TFE3,此种保护作用就会消失。单独敲除TFE3也不能产生保护作用。在多种细胞类型中,TFE3可以激活驱动溶酶体相关基因表达,促进脂质分解。作者分析发现FLCN敲除后,TFE3得到释放进入细胞核,TFE3激活脂质分解代谢程序,下游驱动基因表达上升,限制肝脏脂肪变性。同时在FLCN缺失的肝脏细胞中,从头合成脂肪过程明显受到抑制。这种作用依赖于TFE3对于LXR1和SREBP-1c的抑制作用以及对INSIG2的促进作用,导致脂肪从头合成得到抑制。机制上,作者分析发现FLCN的缺失会导致TFE3的结合模式和结合强度都发生改变。全基因范围内,TFE3结合定位于SREBP-1c附近。这种定位位置的接近性不会产生竞争性的与染色质结合,反而协同促进了TFE3与靶基因的结合。本研究深入阐明了mTORC1在调节肝脏脂质稳态的作用机制,同时发现了FLCN可以作为治疗NAFLD和NASH极具潜力的治疗靶点。Folliculin(FLCN)和FNIP1或FNIP2形成复合物介导RagC或D的GTP水解,RagA/B•GTP–RagC/D•GDP这一种复合物状态能招募mTORC1到溶酶体膜上。早前的研究提示了这一调节的结构基础,但FLCN对TFEB/3的特异调节机制尚未清楚。而Birt–Hogg–Dubé syndrome由FLCN失活突变造成。肾脏敲除flcn-/-小鼠呈现了囊肿的BHD表型,提示了不同器官中FLCN的不同重要作用。进一步提示作为治疗NAFLD和NASH极具潜力的治疗靶点,FLCN的调节需特异控制在肝脏范围。来自哥伦比亚大学的 Henry N. Ginsberg和耶鲁大学的Arya Mani共同为此研究发表了题为Complex regulation of fatty liver disease的观点型文章。他们认为虽然本研究发现FLCN可以作为治疗NAFLD相关疾病潜在的治疗靶点,但是关于mTORC以及其中的组成部分在脂肪从头合成以及NAFLD中的作用的相关研究还远未完成。还需要更多个研究来发掘其中可以作为预防治疗NAFLD的靶点,但是又不影响正常细胞代谢的关键调节分子。
https://doi.org/10.1126/science.abf8271