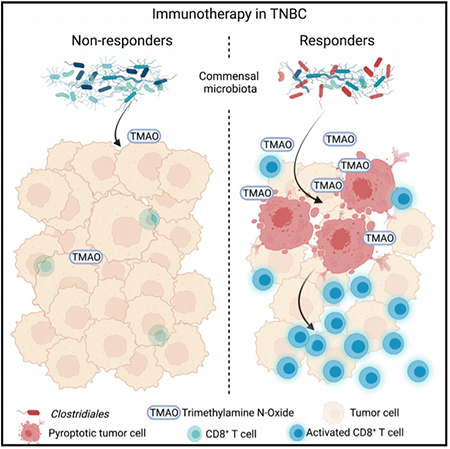
免疫疗法在三阴性乳腺癌 (TNBC) 患者中取得的成功有限,这是一种预后不良的侵袭性疾病。共生微生物群已被证明定植于乳腺,但它们是否以及如何调节肿瘤微环境仍然难以捉摸。2022年3月11日,复旦大学邵志敏,赵超及江一舟共同通讯在Cell Metabolism 在线发表题为”The microbial metabolite trimethylamine N-oxide promotes antitumor immunity in triple-negative breast cancer“的研究论文,该研究对一组 TNBC 患者 (n = 360) 进行了多组学分析,发现梭菌目,相关代谢物三甲胺 N-氧化物 (TMAO) 在具有激活免疫微环境的肿瘤中更为丰富。血浆 TMAO 较高的患者对免疫治疗的反应更好。从机制上讲,TMAO 通过激活内质网应激激酶 PERK 诱导肿瘤细胞焦亡,从而增强体内 TNBC 中 CD8+ T 细胞介导的抗肿瘤免疫。总的来说,该研究结果为微生物-代谢物-免疫串扰提供了新的见解,并表明微生物代谢物,如 TMAO 或其前体胆碱,可能代表一种新的治疗策略,以提高 TNBC 免疫治疗的功效。

免疫疗法是一种很有前途的癌症治疗方法。免疫检查点抑制剂的给药可以通过调节肿瘤微环境和免疫细胞的功能来抑制肿瘤生长。然而,尽管改善了非小细胞肺癌和黑色素瘤等其他类型癌症患者的预后,但免疫检查点抑制剂治疗仅在一小部分三阴性乳腺癌 (TNBC) 患者中提供临床益处,这是最难治的乳腺癌亚型,复发风险高,预后差。对免疫疗法的抵抗可归因于微环境中的异质性。在之前对复旦大学上海癌症中心三阴性乳腺癌 (FUSCCTNBC) 队列的转录组分析中,研究人员发现 TNBC 可分为四种亚型:免疫调节 (IM)、管腔雄激素受体 (LAR)、基底样免疫抑制(BLIS) 和间充质样 (MES)。与其他亚型相比,IM亚型的特点是微环境中免疫激活细胞和免疫刺激物的富集,提示IM亚型TNBC患者可能对免疫治疗有更好的反应。因此,迫切需要确定可以调节 TNBC 微环境和促进抗肿瘤免疫的因素。文章模式图(图源自Cell Metabolism )
先前试图提高 TNBC 免疫疗法疗效的研究主要集中在重塑微环境的宿主因素上,包括突变和差异基因表达。除宿主因素外,共生微生物群已被证明可以定植于乳腺,并且是肿瘤微环境的组成部分。最近,已经做出了大量努力来确定微生物群在重塑宿主免疫系统中的作用。有人提出,脂多糖可以通过诱导 TLR4 信号通路来刺激免疫反应。其他人指出,来自共生微生物群的代谢物和毒力因子可能在介导微生物群与宿主免疫系统之间的串扰中发挥重要作用。然而,由于缺乏大型临床队列和机制研究,共生微生物群与肿瘤微环境之间的串扰仍然难以捉摸。共生微生物群产生的中间代谢物对免疫治疗反应的影响尚未在 TNBC 中进行探索。因此,该研究对 TNBC 队列(FUSCCTNBC 队列;n = 360)的转录组、代谢组和微生物组数据进行了全面分析,发现梭菌目在 TNBC 的免疫激活亚型中更为丰富。有趣的是,微生物衍生的代谢物三甲胺 N-氧化物 (TMAO) 与临床队列中免疫疗法的疗效提高相关。此外,TMAO 激活内质网 (ER) 应激激酶 PERK,在体内诱导肿瘤细胞中 gasdermin E 介导的细胞焦亡并增强 CD8+ T 细胞介导的抗肿瘤免疫。 总的来说,该研究结果为微生物-代谢物-免疫串扰提供了新的见解,并表明微生物代谢物,如 TMAO 或其前体胆碱,可能代表一种新的治疗策略,以提高 TNBC 免疫治疗的功效。https://www.cell.com/cell-metabolism/fulltext/S1550-4131(22)00054-7