结直肠癌肝转移 (CRLM) 是导致 CRC 相关死亡的最常见原因,通常是由 CRC 细胞与肝脏中的肿瘤微环境 (TME) 之间的相互作用引起的。然而,肿瘤衍生的细胞外囊泡 (EV) miRNA 与 CRLM 中的 TME 之间串扰的分子机制尚未完全阐明。
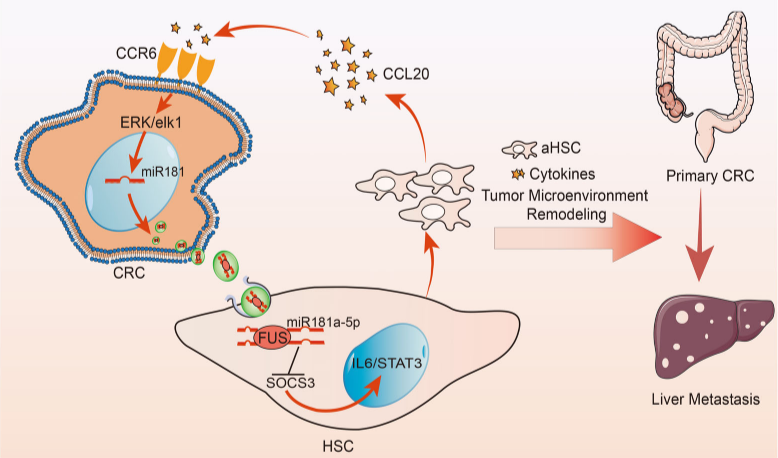
2022年1月18日,复旦大学李大卫及李心翔共同通讯在Journal of Extracellular Vesicles(IF=26)在线发表题为“Highly-metastatic colorectal cancer cell released miR-181a-5p-rich extracellular vesicles promote liver metastasis by activating hepatic stellate cells and remodelling the tumour microenvironment”的研究论文,该研究发现高度转移性 CRC 细胞比表现出低转移潜能的细胞释放更多富含 miR-181a-5p 的 EV,进而促进 CRLM。此外,该研究验证了 FUS 介导 miR-181a-5p 包装成 CRC EV,从而通过靶向 SOCS3 和激活 IL6/STAT3 信号通路持续激活肝星状细胞 (HSC)。
活化的 HSC 可以分泌趋化因子 CCL20 并进一步激活 CCL20/CCR6/ERK1/2/Elk-1/miR-181a-5p 正反馈回路,导致 TME 重编程和 CRLM 中转移前小生境的形成。临床上,含有 miR-181a-5p 的高水平血清 EV 与 CRC 患者的肝转移呈正相关。总之,富含 miR-181a-5p 的高度转移性 CRC 细胞衍生的 EV 可以激活 HSC 并重塑 TME,从而促进 CRC 患者的肝转移。这些结果为CRC肝转移的潜在机制提供了新的见解。

结直肠癌 (CRC) 在全球癌症相关死亡率方面排名靠前,约 50% 的 CRC 死亡是由肝转移引起的。肿瘤细胞与肿瘤微环境(TME)之间的相互作用在结直肠癌肝转移(CRLM)中发挥着重要作用。因此,阐明肿瘤细胞与 TME 之间相互作用的机制似乎对于提高 CRLM 的理解至关重要。在 CRLM 期间,癌细胞可以通过重塑 TME 来诱导转移前小生境的形成。据报道,活化的肝星状细胞 (α-HSC) 特征被发现是继发性或原发性肝癌中最常见的生物学过程。α-HSC 可以从静止状态转分化为高度增殖和移动的肌成纤维细胞。此外,α-HSCs 可以通过重塑和沉积细胞外基质 (ECM) 来影响 CRC 细胞的生长和侵袭。因此,探索 CRC 细胞和 HSCs 之间的相互作用,并阐明潜在的机制可能会导致 CRLM 的预防取得进展。细胞外囊泡 (EVs) 以前根据生物发生机制分为两种主要亚型:内体起源的小 EVs 和质膜衍生的外泌体(微泡/微粒),直径范围分别为40到160 nm 和 50 到 1000 nm。EV 以其脂质双层膜和携带许多生物分子为特征,通常被认为是参与 TME 中细胞间通讯的信使,并已被证明在几种癌症的进展中发挥重要作用。HSC 是肝脏中最丰富的非肝细胞驻留细胞,它们的存在与 CRLM 相关。然而,CRC衍生的EVs是否通过分泌富含miR的EVs调节HSCs以诱导肝转移,以及参与这一过程的miRNAs仍有待确定。文章模式图(图源自Journal of Extracellular Vesicles )
在这项研究中,发现高度转移的 CRC 细胞释放富含 miR-181a-5p 的 EVs,通过调节 CRC 细胞和 HSCs 之间的相互作用和 TME 的重塑促进肝转移。这些发现确定了一种新的 CRLM 特异性生物标志物和一种预测由 CRC 引起的继发性肝癌风险的新策略。 https://onlinelibrary.wiley.com/doi/10.1002/jev2.12186