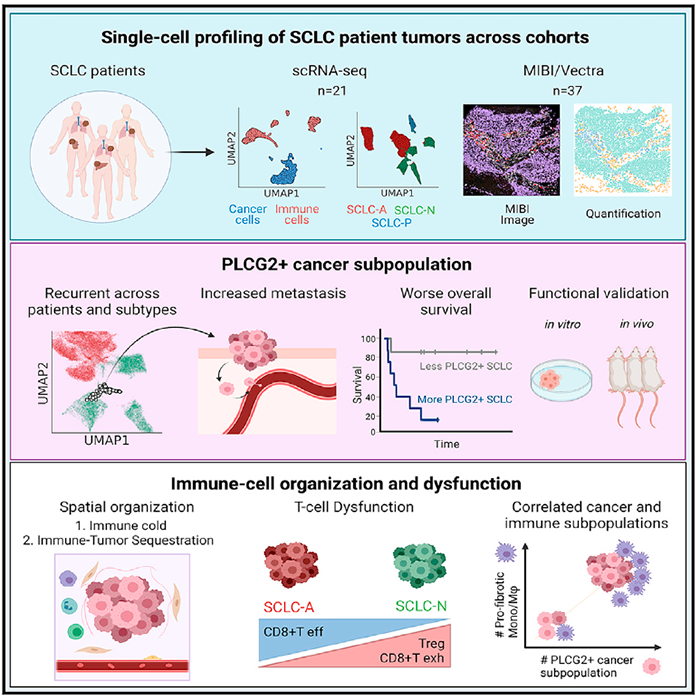
近日,来自美国纪念斯隆-凯特琳癌症中心的Charles M. Rudin团队在Cancer Cell上在线发表题为Signatures of plasticity, metastasis, and immunosuppression in an atlas of human small cell lung cancer 的文章,首次利用单细胞转录组测序和成像技术分析研究临床SCLC标本的异质性和肿瘤微环境,确定了与转移和不良预后相关的PLCG2高表达亚群,并发现具有促纤维化、免疫抑制表型的单核细胞/巨噬细胞群的富集,从而为SCLC的分子特征提供了更深入的表征,具有重要的临床意义。研究人员分析了来自19名患者的21份新鲜SCLC临床样本以及24份肺腺癌(LUAD)和4份癌旁正常肺样本的155,098个细胞的转录组,检测到SCLC中的拷贝数变异(CNV)水平高于LUAD,与SCLC中较高的肿瘤突变负荷一致。根据细胞类型注释,研究人员描述了肿瘤异质性,在38个上皮细胞群中,与预期一样,LUAD和SCLC出现了分别聚集,前者聚为5类,后者则为25类,这与LUAD的较高基质含量一致,而且恶性SCLC细胞的患者间异质性明显高于LUAD细胞。由此表明,尽管SCLC的组织学形态均一,但它具有高度的转录肿瘤异质性,远超过LUAD和正常间质。随后,研究人员采用一种基于邻域图的方法,利用定义每个亚型全部复杂性的多个基因来计算每个细胞中给定SCLC亚型的概率,根据54,534个SCLC细胞数据描述了典型SCLC亚型中的细胞状态,确定了每个细胞最可能的亚型,并据此将每个样本的主要亚克隆分为SCLC-A(N=14)、SCLC-N(N=6)或SCLC-P(N=1)。为了更好地确定SCLC亚型在肿瘤进展中的作用,研究人员评估了不同亚型的细胞组成和基因表达差异。结果显示SCLC-A在原发肿瘤中明显富集,而SCLC-N在淋巴结和远处转移瘤中富集,且SCLC-N肿瘤患者间的多样性高于SCLC-A。与此同时,分析结果发现SCLC-A富含调节细胞周期进程和DNA修复的基因表达,而SCLC-N肿瘤则表现出促转移的的神经元和上皮间质转化表型。与SCLC的转录组多样性形成鲜明对比的,是SCLC患者一贯的不良预后。因此,研究人员分析了多个患者的表型,以确定是否有任何共同的细胞类型可以解释SCLC的普遍侵袭性。SCLC恶性细胞的无监督聚类发现了25类细胞群,大多数细胞集群都是单个肿瘤特异性的,但是其中有一群细胞在样本中反复出现。这一复发性集群中的细胞在亚型分配上的不确定性明显高于其他任何集群中的细胞,表明存在着去分化表型,而且这些细胞富含与转移和神经干细胞相关的基因和基因程序,其中磷脂酶Cγ2(PLCG2)是差异最大的上调基因。进一步地分析发现,与复发性集群的促转移表型一致,与肺相比,PLCG2在转移部位的表达显著上调,在肝脏(SCLC最常见的转移部位)水平最高。细胞和小鼠实验也证实PLCG2的过表达与更强的转移和侵袭直接相关。由此表明PLCG2可能部分驱动了复发性集群的干细胞样、促转移表型。此外,利用MIBI成像,研究人员发现PLCG2高表达肿瘤患者的总体生存率较差,而且此复发性集群也与患者总体生存率降低相关,由此表明具有高PLCG2表达的小型干细胞样促转移亚群在SCLC亚型中具有显著的预后影响。与此同时,研究人员还评估了SCLC亚型对免疫TME的影响。结果显示SCLC,尤其是SCLC-N亚型中的免疫浸润明显减少,而含有更多免疫细胞的SCLC病例则更多的处于免疫隔离。进一步地在单细胞水平上评估SCLC TME内免疫亚群的差异,发现SCLC-A和SCLC-N T细胞群具有组成差异,SCLC-N表现出更大的T细胞功能障碍,包括细胞毒性T细胞的相对耗竭和Treg的增加。此外,研究人员在SCLC肿瘤中发现了一个促纤维化、免疫抑制的单核细胞/巨噬细胞群,该群与复发性PLCG2高表达亚群尤其相关。综上所述,本研究揭示了无法用整体水平亚型来描述的生物学复杂性水平,证明了SCLC肿瘤——尤其是SCLC-N——比LUAD更具异质性,并且SCLC具有可塑性和亚型之间的相互转换(尤其是SCLC-A和-N)的潜力。从本研究获得的图谱可以看出,SCLC的一系列亚型和PLCG2高复发人群征募了不同的基因程序,以定义明显的异质性,并促进免疫抑制严重的TME的转移,由此对新型靶向治疗和免疫治疗方法的设计具有重要的潜在意义。https://doi.org/10.1016/j.ccell.2021.09.008