胰腺导管腺癌(PDAC)已经是最致命的上皮恶性肿瘤之一,其发病率和总体癌症死亡人数都在上升。数十年的研究提高了我们对PDAC致癌机理的理解,包括表征种系易感性、细胞起源、前期病变、遗传改变的序列,包括简单和结构改变、转录改变和亚型、肿瘤异质性、转移进展与肿瘤微环境。随着前瞻性临床试验开始采用基于分子的选择标准来指导靶向治疗,这些基本进展为当前在一级预防、筛查和早期检测、多学科管理和生存方面的转化努力提供了信息。
2021年11月17日,来自加拿大玛嘉烈医院癌症中心的Steven Gallinger教授课题组在Nat Rev Cancer(IF: 60.7)杂志上发表题为“Pancreatic cancer evolution and heterogeneity: integrating omics and clinical data”的综述[1]。胰腺导管腺癌(PDAC)的基因组和转录组数据也被纳入了大约2600种癌症的国际泛癌症分析,这是癌症研究的一个里程碑,通过与其他肿瘤类型的比较,可以进一步了解癌症。

主要结果:
易感性,起源和前体细胞。
在人类中,胰腺导管腺癌(PDAC)被认为来自发生肿瘤的导管上皮。逐步模型假设通过显微镜下可识别的前体病变,包括胰腺上皮内肿瘤(PanINs)、导管内乳头状黏液性肿瘤和黏液性囊性肿瘤,逐渐发育不良至恶性进展。在大多数个体中,这一过程完全是体细胞的,而高达10%的PDAC患者有恶性生殖系倾向。大多数家族聚集要么归因于大量个别低外显率变异,要么尚未解释,但可能是预后、预测和告知筛查策略。
从形态学、遗传学和表达研究以及类器官模型中可以发现,胰腺导管内的上皮细胞是PDAC细胞的起源,而PDAC细胞在细胞异型性方面表现得更高。组织学上,前体病变和PDACs从导管上皮毗连,从低级别发育不良逐步发展到高级别发育不良。较老的Sanger和较新的二代测序数据表明,组织学上正常的导管上皮、PanINs和PDACs具有相似的基因改变。一些显微镜下正常的导管上皮和几乎所有的低级别PanINs都有KRAS突变,而高级别病变更可能包含肿瘤抑制基因改变、端粒缩短和乘客突变,与同步浸润性癌的突变一致。在级别最高的病变中,PanIN异常增生的增加与周期蛋白依赖性激酶抑制剂2A (CDKN2A)的更频繁丢失以及TP53和SMAD4的丢失有关。
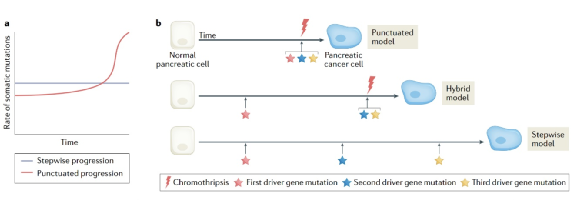
图1:胰腺导管腺癌进展的逐步模型与间断模型比较。
原发性肿瘤的基因改变。
简单的体细胞突变和驱动基因。国际癌症基因组协会(ICGC)目前存储了600多个完整的PDAC外显子组和基因组,这些外显子组和基因组大多来自原发肿瘤的手术切除。点突变和短插入缺失,即所谓的简单体细胞突变,分析发现四个常见的改变基因,即大约90%的PDACs中有KRAS, 80%的TP53, 60%的CDKN2A和40%的SMAD4,随后,一系列基因发生突变的频率高于预期,但个体流行率较低,包括A+T相互作用结构域1A (ARID1A)、赖氨酸特异性去甲基化酶6A (KDM6A)、RING finger 43 (RNF43)、转化生长因子-β (TGFβ)受体2 (TGFBR2)、GNAS(编码Gαs)、MAP3K21、BRAF, SWI/SNF相关的基质相关染色质亚家族A成员4 (SMARCA4),激活素受体2A (ACVR2A), ACVR1B和NRAS。因此,在PanINs中最常见的体细胞突变基因仍然在PDAC中最常见。每个PDAC外显子组平均约有40个简单的体细胞突变,而每个基因组约有6000个。这对于腺癌来说是相对低的。
结构变异,拷贝数改变和基因组不稳定性。微阵列和全基因组测序允许解析结构变异,其导致的拷贝数变化和复杂的染色体重排,这些都是常见的,并与PDAC进展有关。显著重复拷贝数的增加和减少影响已知的PDAC致癌基因,KRAS (12p12.1), GATA6 (18q11.2), MET (7q31.2), NOTCH1 (9q34.3), ERBB2 (17q12), AKT2 (19q13)和MYC (8q24.2),以及肿瘤抑制基因,CDKN2A (9p21.3), SMAD4 (18q21.2), TP53 (17p13.1), BRCA1 (17q21.31), ARID1A (1p36.11), PTEN (10q23.31),polybromo 1 (PBRM1) (3p21.1)和SMARCA4 (19p13.2)。Waddell等人利用染色体内和染色体间的结构变异分布,将PDAC分为4种基因组亚型:稳定型,变异少于50种;分散型,少于200个突变体;局部重排型,只涉及一或两条染色体;以及不稳定型,有200多种突变体。
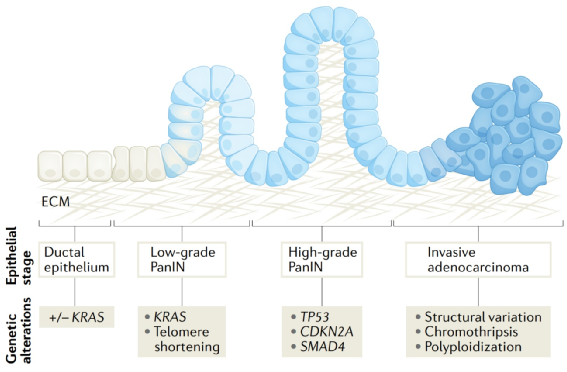
图2:胰腺导管腺癌进展的组织学分期。
转录亚型。
PDAC的基因表达研究最初集中于通过手术切除获得的原发肿瘤的亚型,三个独立的命名系统相继发表,即Collisson等人的三组分类(经典、准间质或外分泌样)。Moffitt等人的两组分类(基底样或经典)和Bailey等人的四组分类(鳞状、免疫原性、胰腺祖细胞或异常分化的内分泌外分泌(ADEX))。在PDAC切除患者的多因素分析中,上述每一项都是生存预后因素。这些转录研究也揭示了PDAC的生长模式。从形态学上看,PDAC可被分类为具有超过或少于40%的腺体形成,且观察者间一致性高,与经典或基底样基因表达的强烈关联。超过30%的侵袭性肿瘤的鳞状形态也与几个组的基底样肿瘤相关。
转移和肿瘤异质性。
在诊断时,只有20%的PDACs是局限性的,超过30%扩散到区域淋巴结,超过50%转移到其他实体器官,主要是肝和肺。5年生存率与分期呈显著负相关:局部疾病约40%,区域播散约10%,远处疾病约2%。然而,鉴于这些组织的可用性,大多数研究集中在前期病变和原发性肿瘤上。了解原发肿瘤向转移的进展需要认识到肿瘤内和肿瘤间的异质性,而这两者在PDAC中密切相关。原发肿瘤中的许多基因改变是亚克隆的,发生在低于1的癌细胞部分,这意味着它们并不存在于每个癌细胞中,导致肿瘤内异质性。将原代PDAC大体切片成多个3D片段进行靶向测序,结果表明,在空间分布的亚克隆细胞群的主体肿瘤中存在嵌合现象,每个亚克隆细胞群具有相似癌细胞组分的主要突变。解剖上不同的转移瘤具有与原发肿瘤中这些特定亚克隆细胞群相对应的突变相似的特征。

图3:胰腺导管腺癌基于表达的亚型。
癌症进展的时机。
我们对PDAC从正常导管上皮到前体病变,再到恶性肿瘤和转移的进化过程有了显著的了解,由此可以提出一个全面的模型,如图4所示。估计从PDAC前期病变到侵袭到转移所需的时间也引起了人们的极大兴趣,因为这对基因高风险或基于人群的筛查策略具有明显的影响。早期的报道表明,接受多灶PanINs慢性胰腺炎切除术的患者在3-10年内发展为PDAC。模型之后开发使用变量,包括中性突变的数量搭配主要肿瘤和转移,胰腺细胞分裂率和每个碱基对突变率,估计从第一个体细胞突变的时间的起源的入侵细胞10-12年,从那时到指标转移细胞起源的时间为6-7年,从扩散到患者死亡的时间为2-3年。这些相对较大的间隔意味着有大量的干预机会,这在基于成像的筛查试验中尚未实现。
肿瘤微环境。
由于新技术的应用,我们对PDAC中外部微环境的认识也有所提高,包括PDAC特征的密集肿瘤相关基质、胰腺微生物组和抗肿瘤免疫反应迟钝的作用。致密间质主要由癌症相关成纤维细胞(CAFs)、免疫细胞和内皮细胞组成。长期以来,这种间质增强恶性肿瘤的假设受到了挑战,因为观察到两个间质耗尽的小鼠模型,矛盾的是,显示出PDAC的侵袭性增加,而且间质靶向药物的临床试验失败。通过大量RNA测序,Moffitt等人将PDAC间质分为正常和激活两种亚型,这两种亚型独立于肿瘤亚型,可与任何一种亚型配对(经典或基底样)。肿瘤微环境对PDAC进展影响的进一步描述最近在类器官和细胞系研究中得到证实。将患者来源的类器官注射到小鼠胰管或间质中,导致了基于表达的亚型、增殖率、组织学和间质反应程度的差异,证明肿瘤微环境在一种机制中影响癌细胞的特性,该机制已被证明涉及TGFβ信号转导。在一项单独的研究中,PDAC和CAF细胞株以不同比例共培养,然后进行单细胞测序,结果显示两种细胞类型的基因表达差异取决于混合程度,这意味着两者之间存在串音,这再次表明这是由TGFβ信号传导介导的。
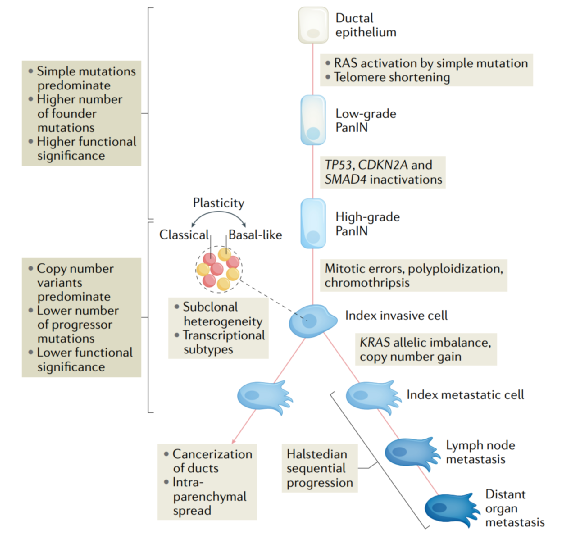
图4:胰腺导管腺癌的进化模型。
结论和展望:
这篇综述讨论了PDAC组学的研究,强调了到目前为止适当的发现的临床相关性。种系易感性被归因于少数高外显率和可能更多的低外显率遗传变异,尽管造成很大一部分可遗传PDAC的基因仍然未知。PDAC的癌变过程是从细胞起源,通过前期病变到侵袭性疾病,通过少数驱动基因中简单和结构性的遗传改变的可预测序列进行。PDAC进化模型和因此的进展时间可以是渐进的和逐步的或快速的和间断的。体细胞驱动突变导致流体转录改变,使肿瘤分类为预后和预测亚型,我们发现原发性PDAC与转移性PDAC可能不同。肿瘤异质性和肿瘤微环境的特征和意义开始被理解。具体来说,外部因素包括基质亚型、肿瘤和抗肿瘤免疫信号通路以及微生物群。
个性化癌症诊疗的前提是,患者的癌症可以实时被分子表征,告知预后和预测治疗反应。由于积极的多学科团队的不懈努力,这一度似乎不可克服的挑战胰腺肿瘤学现在是在视野之内。
原文链接:https://www.nature.com/articles/s41568-021-00418-1
参考文献:
[1] Connor AA, Gallinger S. Pancreatic cancer evolution and heterogeneity: integrating omics and clinical data. Nat Rev Cancer. 2021 Nov 17. doi: 10.1038/s41568-021-00418-1. Epub ahead of print. PMID: 34789870.













