肿瘤免疫治疗的策略之一就是使免疫系统特异性靶向肿瘤细胞而不是正常细胞。而突变相关的新抗原(neoantigen)正是这样的靶标,肿瘤细胞中体细胞突变产生的序列改变的肽段被细胞处理,被主要组织相容性复合体(major histocompatibility complex,MHC)呈递至细胞表面,进而被T细胞识别,对肿瘤细胞进行杀伤。由于新抗原只在肿瘤细胞中存在,其成为肿瘤免疫治疗的热门靶标之一【1】。但是大部分肿瘤只有有限的肿瘤突变荷载并不能够产生新抗原相关的反应,同时只有5%的新抗原能被MHC分子提呈,而能激活有效的杀伤性T细胞的新抗原更少【2】。同时,肿瘤细胞中大部分的促癌因子和蛋白都是胞内蛋白,这也限制它们作为新抗原被人白细胞抗原(human leukocyte antigen, HLA, 人MHC分子)呈递作为肿瘤治疗的靶标【1】。神经母细胞瘤(Neuroblastoma)是儿童中常见的一种恶性肿瘤,其具有很少的肿瘤突变,相反其是由于转录调控网络表观遗传学上的失调而引起的【3】。在实体瘤,尤其是肿瘤突变荷载少的实体瘤中发现特异性以及免疫原性都较好的肿瘤免疫治疗新靶标,一直以来是肿瘤免疫治疗存在的挑战。
2021年11月3日,来自美国宾夕法尼亚儿童医学院的John M. Maris团队在Nature上发表题为Cross-HLA targeting of intracellular oncoproteins with peptide-centric CARs的文章。团队分析神经母细胞瘤的免疫肽组,在HLA-A*24:02上发现来自神经母细胞瘤主要促癌转录因子PHOX2B的未突变肽段QYNPIRTTF具有很好的肿瘤特异性,以该肽为中心设计的CARs能识别多种不同HLA呈递的QYNPIRTTF,且在体外和小鼠模型中具有不错的效果。

高度多态性的人白细胞抗原(HLA-A,-B,-C)基因编码的MHCI分子能够将来自于细胞内蛋白质组的一段8-14个氨基酸长度肽段提呈至细胞表面,这些肽段为免疫肽组(immunopeptidome),随后T细胞识别监视这些肽-MHC复合体(pMHC),发现来自于外来病原的抗原。研究团队假设肿瘤细胞的免疫肽组中存着在一部分来自于肿瘤发生必须的促癌因子的特异性的肽,针对这些肽便可设计出以肽为中心的嵌合抗原受体(peptide-centric CARs, PC-CARs)来特异性靶向肿瘤细胞。
首先,研究团队对8个神经母细胞瘤细胞来源的异种移植物和病人来源的异种移植物(cell-derived xenografts (CDX), patient-derived xenografts PDX)进行免疫肽组的检测,通过MHC的捕获,肽段洗脱以及后续LC-MS/MS质谱等一共发现了7608个肽段。筛选这些肽段和HLA的结合力,筛选到2286个强亲和力的肽段。随后分析肿瘤组织和正常组织的RNA-Seq数据,研究团队筛选到61个肽段,其来源的母基因在肿瘤组织中高表达。最后研究团队分析正常组织中MHC肽组,进一步把可能在正常组织中提呈的肽段筛选掉。最后得到13个肽段,其来自于9个特异在神经母细胞瘤中表达的基因。同时研究团队在原代神经母细胞瘤中也进行同样的免疫肽组筛选,发现56个肽段。CDX和PDX筛选的13个肽有7个在原代肿瘤细胞中也被筛选到。随后,根据pMHC结合力,HLA等位基因频率,母基因表达情况以及神经母细胞瘤生物学信息对这些肽进行排序,6条分别来自来自CHRNA3, GFRA2, HMX1, IGFBPL1, PHOX2B 和TH的肽段被选择继续研究。分析不同发育时期的转录组学数据,研究团队发现PHOX2B只在胎儿发育过程中表达而在出生前的正常组织中PHOX2B完全被沉默。PHOX2B也是神经母细胞瘤发生的主要调控因子,PHOX2B的表达也是神经母细胞瘤诊断检测的手段之一。这表明,PHOX2B是神经母细胞瘤高度特异性的肿瘤抗原且是免疫治疗的理想靶标。
由于自身抗原的免疫原性较弱,研究团队决定设计基于scFv-CARs而不是TCRs来靶向PHOX2B。随后研究团队筛选sc-Fvs库,寻找能结合PHOX2B肽的特异性克隆,并通过sCRAP算法预测排除其抗原交叉反应。研究团队筛选到10LH克隆并进一步研究,scFv 10LH和PHOX2B具有很强的亲和力,KD为13 nM,kd是 7.6 × 10-4 s-1。据此,研究团队设计出识别在HLA-A*24:02上提呈的PHOX2B 9氨基酸肽QYNPIRTTF的PC-CARs。发现PHOX2B 9氨基酸肽QYNPIRTTF也可被其他类型的HLA-A提呈,而10LH PC-CARs能打破传统的HLA限制和不同种类pMHC识别结合。随后在体外细胞模型以及体内PDX模型中证明了PHOX2B特异性的PC-CAR T细胞的跨HLA肿瘤杀伤能力。
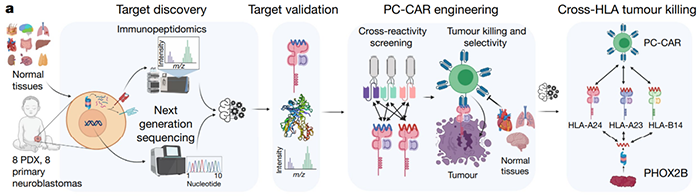
图1 肿瘤抗原的发现以及PC-CARs设计工作流程
本文利用多种技术手段从非突变的促癌蛋白中发现神经母细胞瘤的肿瘤特异性抗原,并靶向这些肿瘤自身肽段设计出了PC-CARs,具有较好的肿瘤杀伤能力以及跨HLA的反应活性。该方法将非免疫原性的胞内促癌蛋白纳入到选择中,极大扩大了肿瘤免疫治疗的候选靶标,有助于神经母细胞瘤以及其他肿瘤的免疫疗法的发展。同时打破传统的HLA限制,也会扩大肿瘤免疫治疗的受益人群。
原文链接:
https://doi.org/10.1038/s41586-021-04061-6
参考文献
1. Pearlman, A.H., et al., Targeting public neoantigens for cancer immunotherapy. Nature Cancer, 2021. 2(5): p. 487-497.
2. Leko, V. and S.A. Rosenberg, Identifying and Targeting Human Tumor Antigens for T Cell-Based Immunotherapy of Solid Tumors. Cancer Cell, 2020. 38(4): p. 454-472.
3. Durbin, A.D., et al., Selective gene dependencies in MYCN-amplified neuroblastoma include the core transcriptional regulatory circuitry. Nat Genet, 2018. 50(9): p. 1240-1246.













