近年来,大量研究表明:在不同的营养状态下,代谢酶表达水平、亚细胞定位以及酶活的改变,能够使代谢酶以精确而有效的方式调控细胞信号传导和基因表达等生理活动。而代谢酶相关的生理调节作用基本上可以归因于代谢产物的生成,其中代谢产物可以为蛋白质或染色质修饰反应提供“燃料”【1,2】。3-磷酸甘油酸脱氢酶(PHGDH)是丝氨酸合成途径的第一个限速酶,其主要负责将糖酵解中间产物3-磷酸甘油酸(3-PG)转化为3-磷酸羟基丙酮酸(3-PHP),最终进入一碳循环,从而维持相应的物质稳态【3】。就PHGDH对肿瘤细胞生长的作用而言,其功能似乎并不简单地等同于丝氨酸生成,因为有研究表明PHGDH缺失引起的细胞生长受损不能通过补充外源性丝氨酸来弥补【4】。这些现象表明PHGDH具有更广泛而未知的生理作用;而对这些功能的研究能更合理解释PHGDH缺失对细胞生长的非丝氨酸依赖的影响。
2021年10月18日,上海交通大学医学院附属仁济医院蒋玉辉团队和华东理工大学药学院赵玉政团队在Nature Metabolism杂志上发表了题为The alternative activity of nuclear PHGDH contributes to tumor growth under nutrient stress的文章,这项研究深入揭示了葡萄糖缺失条件下PHGDH通过核易位以及酶活转变调控细胞核NAD+和肿瘤细胞生长的分子机制。

蒋玉辉研究员团队近些年研究工作主要聚焦于外界压力信号下(如葡萄糖缺失和低氧等条件)细胞中代谢酶的状态改变及其在肿瘤发展中的作【5-7】。在以往研究基础上,本项目主要以PHGDH作为分子研究对象。研究人员首先发现除了正常葡萄糖浓度,在葡萄糖缺失培养条件下,向细胞补充外源性的丝氨酸也并不能有效回补PHGDH缺失对细胞生长造成的损伤。代谢物分析表明葡萄糖缺失使细胞内的3-PG大幅度下降,远低于PHGDH对于3-PG的Km值;因此理论上来说,葡萄糖缺失本身会导致3-PHP产生受阻,这并不依赖于PHGDH。因此研究人员推测葡萄糖缺失条件下PHGDH影响细胞生长可能并不通过3-PHP的生成,而是通过其它未知效应。
研究人员进一步发现葡萄糖缺失条件下,PHGDH Ser371被p38 MAPK磷酸化,从而促使胞质定位的PHGDH转位到细胞核;并且阻碍PHGDH的细胞核转运抑制了该条件下肿瘤细胞的生长。由于PHGDH介导的3-PG向3-PHP转变的代谢反应会伴随着NAD+向NADH的还原反应,为了进一步验证核内PHGDH的生理作用,研究人员探究了PHGDH的转运与核内NAD+/NADH代谢的相关性。
针对细胞内核心代谢物NAD(P)(H)等,近几年赵⽟政教授团队研发了系列原创性、⾼性能的遗传编码荧光探针,如NAD+/NADH比率探针SoNar【8,9】、NADPH探针iNap【10,11】、NAD+探针FiNad【12】等,并建立了“高通量”与“全景式”活细胞代谢监测分析方法。为了检测活细胞内NAD+/NADH 比率和NAD+水平,研究人员将SoNar和FiNad探针标记细胞核特异性信号肽,以便更好地探究 NAD+ 或 NADH在哺乳动物细胞中的核分布。惊奇地发现,葡萄糖缺失条件下,阻碍PHGDH的细胞核转运也导致了细胞核内NAD+水平的上升。
由于上述所说细胞内的3-PG水平在葡萄糖缺失条件下受限,这也暗示着PHGDH可能通过识别其它底物从而调控NAD+水平。以往研究报道:3-PG的类似物如2-羟戊二酸(2-HG)和苹果酸(malate)(结构式存在2-羟基丙酸基团),可以作为PHGDH的潜在底物被氧化分别转变为α-酮戊二酸(α-KG)和草酰乙酸(OAA),并伴随NAD+的还原【13】。蛋白质谱分析结果表明:葡萄糖缺失条件下AMPK介导了PHGDH Ser55磷酸化;而此磷酸化显著增强了PHGDH对底物malate而不是3-PG及2-HG氧化的催化活性,促进了NAD+ 向NADH的还原生成。而接下来一系列实验也表明细胞核内PHGDH对于malate的氧化作用对于抑制细胞核NAD+水平起到了至关重要的作用。
此外,研究人员发现PHGDH与第73位丝氨酸磷酸化的c-Jun相结合,通过局部对于NAD+调控特异抑制了PARP1介导的c-Jun聚ADP-核糖化修饰(poly(ADP-ribosyl)ation),因此导致c-Jun其参与细胞生长阻遏相关基因表达的转录活性受阻;在临床胰腺癌样本中,PHGDH Ser371和Ser55磷酸化水平分别与p38和AMPK激酶活性呈正相关;而总体在生理功能方面,营养应激下细胞核内的PHGDH通过其介导苹果酸氧化催化功能调控c-Jun转录活性从而维持了肿瘤细胞生长和肿瘤发展。
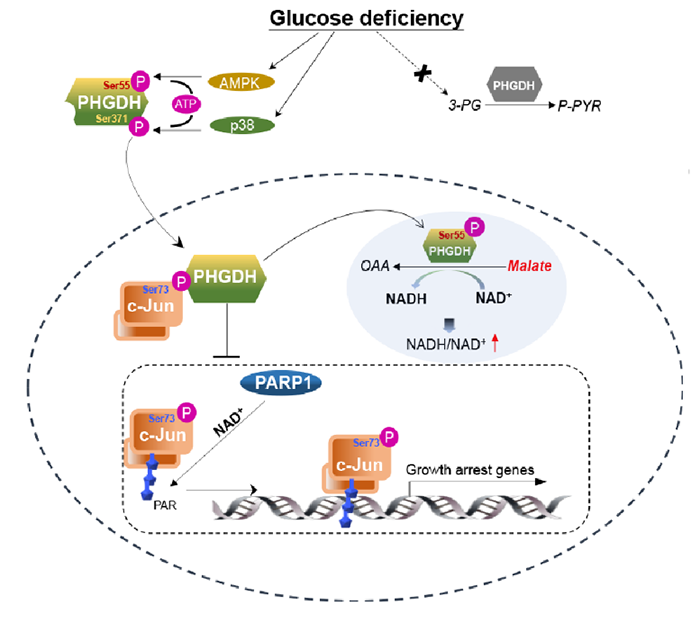
图一 葡萄糖缺失条件下PHGDH对于“细胞核NAD+”以及“c-Jun生长抑制效应”的负调控作用
此研究阐明了PHGDH非典型代谢活性调控肿瘤生长的分子机制,并强调了其酶活的改变在肿瘤发生中的功能意义,这将为肿瘤治疗新策略的开发提供新思路。
据悉,上海交通大学医学院附属仁济医院蒋玉辉研究员和华东理工大学药学院赵玉政教授为本文共同通讯作者。上海市第一人民医院马春敏博士,上海交通大学医学院博士研究生郑珂和华东理工大学博士研究生姜坤为本文共同第一作者。
参考文献













