Src作为第一个被鉴定的癌症基因,在癌细胞系和大量的病人肿瘤组织中都呈现出异常的表达和活性。Src的过度激活会促进肿瘤生长和癌细胞转移,并且含有更高水平pSrc的组织会更容易表现出抗药性。因此,能够在活细胞中以超高的时空分辨率解析Src活性调控的动态过程,对于深入理解Src致癌的分子机制以及后续药物的研发具有重要意义。
生物传感器(biosensor)可用来在时间和空间上定量研究生物分子的构象或者活性动态变化。活体生物研究中常使用基于荧光共振能量转移(FRET)的传感器,但其灵敏度低。此外,传感器的构建通常利用某个识别特定构象的蛋白片段。这些片段多来源于下游效应器,其特异性差且会与内源配体竞争,干扰正常的调控。
2021年10月11日,University of North Carolina at Chapel Hill的Klaus M. Hahn和Timothy C. Elston团队(共同一作为刘贝和Orrin J. Stone、Michael Pablo)在Cell上发表了文章Biosensors based on peptide exposure show single molecule conformations in live cells。作者们开发了binder/tag技术,可以通过简单的蛋白质工程学操作构建灵敏的、适用于单分子追踪的生物传感器。新的传感器不依赖于目标蛋白本身的氨基酸序列,且识别位点远离蛋白本身的活性位点,因此其特异性好、干扰小,更适于推广到其他蛋白的活性研究中。

Binder/tag方法利用一对短肽(tag)和蛋白(binder)的特异性相互作用(图1A)。作者们通过选择tag的插入位点,在目标蛋白处于失活状态时,tag被隐藏在蛋白内部。目标蛋白被激活后,暴露出tag,进而binder能够与tag相互作用(图1B)。因此binder和tag的共定位即反映了靶标的激活状态,或者特殊情况下可仅通过追踪binder的定位来指示目标的激活状态。Binder/tag的概念很容易推广到其他蛋白上,文中同时阐释了tagSrc,tagFyn,tagSyk以及tagFAK的构建,并确定了另外一组短肽/蛋白对,以用来同时成像多种蛋白活性。
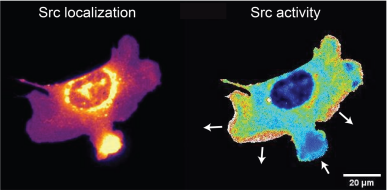
Binder/tag也可用来构建基于FRET的传感器。在确定tag插入位点后, 只需将FRET对(例如CFP-YFP)分别融合在tagSrc和binder的末端。在单细胞中,作者发现Src仅在细胞伸展的时候被激活,而在收缩时瞬间失活(图2)。
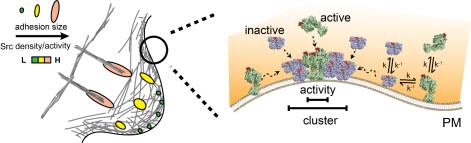
驱动细胞行为的机制通常是跨尺度的。作者们利用HaloTag和SNAP-tag在细胞内通过荧光染料标记tagSrc和binder,进而在单分子尺度下追踪Src分子的运动轨迹和构象变化。利用Binder/tag,作者研究了Src在黏着斑(adhesion)上富集及激活的动态过程,并在纳米尺度下揭示了蛋白质簇(cluster)内Src的构象状态及分布。最后,利用随机建模,作者确定了单个Src分子激活的动力学(图3)。
原文链接:
https://doi.org/10.1016/j.cell.2021.09.026













