转移是癌症患者大多数死亡的原因,并且在机制上仍然知之甚少。迫切需要破译癌细胞转移背后的调控网络。据报道,核仁蛋白 7 (NOL7) 可作为宫颈癌的肿瘤抑制因子。
2021年10月13日,福州大学贾力及俄罗斯远东联邦大学Vladimir L. Katanaev共同通讯在Signal Transduction and Targeted Therapy (IF=18.19)在线发表题为“NOL7 facilitates melanoma progression and metastasis”的研究论文,该研究表明 NOL7 对黑色素瘤的进展和转移发挥促癌作用。
从功能角度来看,NOL7 有利于细胞存活,并通过促进细胞增殖、细胞周期进程和侵袭性以及获得化学和失巢凋亡抗性来促进黑色素瘤的肿瘤生长和转移。从机制的角度来看,NOL7 作为 HIF-1α/NOL7/HRas/PI3K/AKT/ERK 轴中的新参与者出现,最终激活细胞周期、细胞凋亡和 EMT 的调节因子以发挥其致癌功能。因此,该研究将 NOL7 确定为恶性活动的多功能调节剂,建议将其作为黑色素瘤进展的新型生物标志物和未来治疗的潜在药物靶点。

转移是癌症患者大多数死亡的原因,并且在机制上仍然知之甚少。迫切需要破译癌细胞转移背后的调控网络。据报道,核仁蛋白 7 (NOL7) 可作为宫颈癌的肿瘤抑制因子。该研究揭示了 NOL7 在黑色素瘤中的新型促肿瘤能力。该研究首先检测到 NOL7 在转移性黑色素瘤中的表达与其在原发部位的表达相比,通过用于相对和绝对定量蛋白质组学筛选的同量异位标记上调,通过分析 NOL7 蛋白和信使 RNA(mRNA)水平进一步证实了这一发现。重要的是,NOL7 表达随着从良性痣到原发性黑色素瘤并进一步发展为转移性黑色素瘤的疾病进展而增加。先前的研究表明,黑色素瘤通常与染色体区域 6p 的扩增有关,特别是 NOL7 基因所在的 6p21-23,并且该区域在宫颈癌中经常发生杂合丢失。 因此可以预测 NOL7 表现出不同的表达模式,并在黑色素瘤和宫颈癌中发挥不同的作用。为了研究 NOL7 在不同黑色素瘤活动中的作用,该研究通过黑色素瘤细胞系 B16F10 和 A375 中的特定小干扰 RNA 和 CRISPR/Cas9 基因编辑系统抑制 NOL7 表达。通过这种方法,该研究观察到 NOL7 敲低/敲除显著降低了增殖能力。NOL7 敲低的这些影响与细胞周期调节因子 CDK2、细胞周期蛋白 A 和细胞周期蛋白 E 的水平降低相关,并且与细胞周期进展抑制剂 p21 和 p27 的水平相互增加相关。然后开始研究 NOL7 在黑色素瘤细胞凋亡中的潜在作用。基于膜联蛋白 V-FITC/PI 和 JC-1 染色的细胞凋亡测定表明 NOL7 敲低/敲除细胞的细胞凋亡指数较高。此外,与对照黑色素瘤细胞相比,MTT 测定显示 NOL7 敲低细胞对紫杉醇的敏感性更高。总之,这些结果表明黑色素瘤 NOL7 在调节细胞凋亡和细胞适应以及针对应激条件(如化疗或失巢凋亡)的保护中的重要性。接下来,开始研究 NOL7 在转移中的功能。在 NOL7 敲低后,B16F10 和 A375 细胞的运动性、粘附性、迁移和侵袭性显著降低。此外,NOL7 耗竭增加了上皮标志物 E-钙粘蛋白的表达,并降低了 B16F10 和 A375 细胞中间充质标志物 N-钙粘蛋白、mmp9、波形蛋白的水平。因此,这些发现通过多种方式证明了 NOL7 在体外黑色素瘤的侵袭行为中起着至关重要的作用。进一步研究NOL7在体内黑色素瘤生长和转移中的作用,该研究使用A375-sgNOL7细胞和对照细胞建立皮下肿瘤小鼠模型和实验转移模型。该研究发现NOL7敲除显著减少了裸鼠皮下肿瘤的生长和肺转移结节。此外,观察到 NOL7 与实验转移模型中小鼠的总体存活率相关。
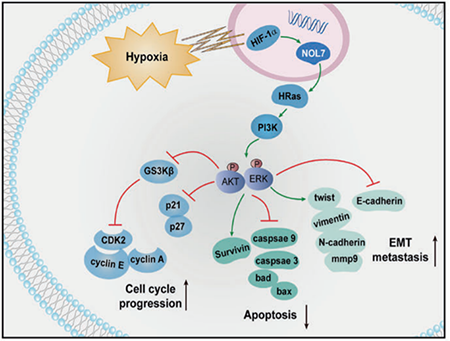
文章模式图(图源自Signal Transduction and Targeted Therapy )
使用蛋白质印迹法测试暴露于缺氧条件 (1% O2) 不同持续时间的 A375 细胞中缺氧诱导因子-1α (HIF-1α) 和 NOL7 的表达。该研究发现与 HIF-1α 一样,NOL7 表达在缺氧时积累。在 A375 细胞中敲除 NOL7 后,缺氧仍导致 HIF-1α 表达增加,进一步与缺氧-HIF-1α-NOL7 轴一致。为了提供支持该轴的直接证据,该研究使用双荧光素酶报告基因测定进一步确定了 HIF-1α 在 NOL7 启动子序列上的转录活性。事实上,HIF-1α 可以通过促进 NOL7 转录来诱导 NOL7 表达。此外,在缺氧条件下培养 A375 细胞促进了非极性上皮表型向极性间充质表型的转化,并改变了上皮间充质转化 (EMT) 相关蛋白的表达(E-钙粘蛋白、N-钙粘蛋白、波形蛋白和纤连蛋白) 。然而,NOL7 耗竭逆转了缺氧诱导的 EMT。缺氧处理后,A375 细胞对紫杉醇的侵袭、迁移和化学抗性显著增强,而 NOL7 敲除损害了升高的细胞侵袭和迁移特性以及化学抗性。因此,NOL7 在缺氧条件下由 HIF-1α 诱导,并且是 HIF-1α 诱导的 EMT、侵袭性和化学抗性所必需的。假设 NOL7 可以影响 HRas mRNA 翻译效率,从而调节 HRas 蛋白水平和 PI3K/AKT/ERK 信号通路。事实上,该研究发现 NOL7 消耗显著降低 B16F10 和 A375 黑色素瘤细胞中的 HRas 蛋白水平,而 HRas 转录水平不受影响。总之,该研究表明 NOL7 对黑色素瘤的进展和转移发挥促癌作用。从功能角度来看,NOL7 有利于细胞存活,并通过促进细胞增殖、细胞周期进程和侵袭性以及获得化学和失巢凋亡抗性来促进黑色素瘤的肿瘤生长和转移。从机制的角度来看,NOL7 作为 HIF-1α/NOL7/HRas/PI3K/AKT/ERK 轴中的新参与者出现,最终激活细胞周期、细胞凋亡和 EMT 的调节因子以发挥其致癌功能。因此,该研究将 NOL7 确定为恶性活动的多功能调节剂,建议将其作为黑色素瘤进展的新型生物标志物和未来治疗的潜在药物靶点。https://www.nature.com/articles/s41392-021-00676-3















