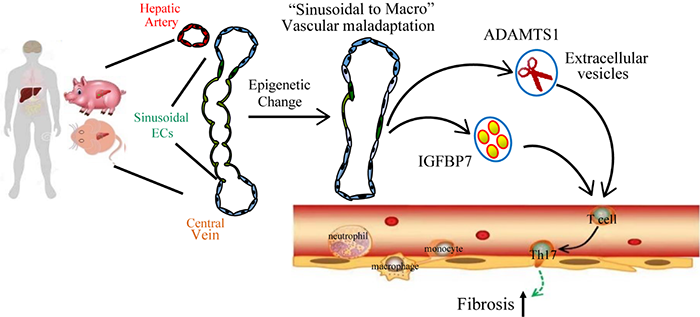
2021年10月6日,曹中炜和丁楅森课题组与华西医院陈利平合作在Science Translational Medicine杂志发表题为Targeting epigenetically maladapted vascular niche alleviates liver fibrosis in nonalcoholic steatohepatitis的论文,解码了血管内皮细胞在NASH中促进肝纤维化的细胞学变化及所涉及的表观遗传机制,并发现病变肝内皮细胞表达的angiocrine节点作为肝纤维化疾病治疗靶点以及诊疗标志物的临床转化意义。肝血供由肝静脉、肝动脉和门静脉之间的窦状血管系统完成。窦状血管系统中有一层表达表达CLEC4G和OIT3的窦内皮细胞和表达CD34的大血管内皮细胞。因此,不同解剖部位的肝脏内皮细胞表现出特殊的形态和表型标记,具有“窦-大血管”的血管层次和器官内分类。然而,目前的临床或临床前模型还没有系统地在单细胞水平上阐明特定的肝血管内皮亚群在NASH病理发生中的功能贡献。本文第一作者张华博士,研究生马永源和黄星铭通过与华西医院陈利平合作,对人肝硬化患者肝脏非实质细胞(NPCs)进行单细胞测序(scRNA-seq)分析,发现硬化NPCs中,血管内皮细胞变化最显著,硬化病人肝脏中大血管内皮细胞比例显著增加,窦内皮细胞显著减少,并且发生“窦-大血管”内皮失调。组蛋白修饰显示,与实质细胞相比,人硬化肝脏中NPCs组蛋白乙酰化显著降低。进一步分析显示硬化内皮细胞中组蛋白修饰和DNA甲基化相关的基因变化最多。内皮特异性敲除小鼠揭示肝脏内皮细胞中HDAC2和DNMT1的异常活化在NASH模型中导致“窦-大血管”内皮失调,进而导致肝脏纤维化。在敲除鼠研究基础上,张华、马永源和成鑫英建立了能更好模拟人代谢紊乱的小型猪NASH模型。小型猪在NASH模型中血清葡萄糖、肝纤、肝损伤、胶原沉积、脂质沉积等指标均有显著升高,并出现明显的假小叶肝硬化表型,而HDAC2和DNMT1抑制剂治疗后明显改善了小型猪的肝脏纤维化及血液学指标。单细胞测序显示NASH小型猪也发生“窦-大血管”内皮失调。而利用HDAC2和DNMT1抑制剂的联合治疗手段在小型猪NASH模型中逆转了“窦-大血管”内皮失调并促进了纤维化肝再生。联合华西医院吴东波组,研究团队发现人和猪的硬化肝脏血管窦内皮细胞中发生血管旁分泌angiocrine因子重编程,其中促纤维化的IGFBP7和ADAMTS1表达显著升高。在肝硬化/纤维化病人血浆中,IGFBP7和ADAMTS1水平也明显升高。值得注意的是与传统肝损伤指标ALT或AST相比,IGFBP7和ADAMTS1在病人中可作为更灵敏的肝脏纤维化生物学标志物。通过比较不同诱因的肝脏纤维化病人以及NASH不同阶段血浆,作者发现不同诱因的肝硬化/纤维化患者血浆中IGFBP7和ADAMTS水平均明显升高,尤其是这两个指标可有效区分NASH和单纯脂肪变性患者。最后,作者通过基因敲除小鼠和人内皮细胞外囊泡移植实验揭示了IGFBP7+和ADAMTS1+的窦内皮细胞通过激活TH17细胞促进了肝脏纤维化或硬化。本研究在单细胞水平上解析了血管内皮细胞通过表观遗传变化激活TH17细胞导致肝脏纤维化的angiocrine机制。结果显示了在NASH中angiocrine IGFBP7和ADAMTS1作为血管微环境治疗靶点和肝纤维化生物标记物的转化意义。四川大学张华博士、吴东波博士、马永源、成鑫英、黄星铭博士研究生为本文的第一作者。通讯作者是四川大学曹中炜,丁楅森,和陈利平。四川大学曹中炜为国家杰青,在华西二院/生物治疗国家重点实验室与丁楅森组长期合作研究纤维化器官及肿瘤血管微环境。该团队长期招聘生物信息学,蛋白组学,动物模型,临床研究等多学科的副研究员和博士后,并欢迎感兴趣的研究生及本科生加入。www.science.org/doi/10.1126/scitranslmed.abd1206