近日,德国BioNTech公司Ugur Sahin与法国赛诺菲公司Timothy R. Wagenaar等研究人员合作在Science Translational Medicine上发表了题为Local delivery of mRNA-encoding cytokines promotes antitumor immunity and tumor eradication across multiple preclinical tumor models的研究论文,评估了局部递送编码促炎细胞因子的mRNA对抗肿瘤免疫的效果。

首先,为了评估瘤内给药mRNA的翻译效果,研究人员使用了标准的核糖核苷酸或含有N1-甲基假尿苷三磷酸(m1ΨTP)的萤火虫荧光素编码mRNA。通过将mRNA注射到携带皮下MC38共生肿瘤的小鼠体内,生物发光成像结果表明,mRNA中用尿苷代替m1Ψ会增加瘤内的荧光素酶表达(图1)。
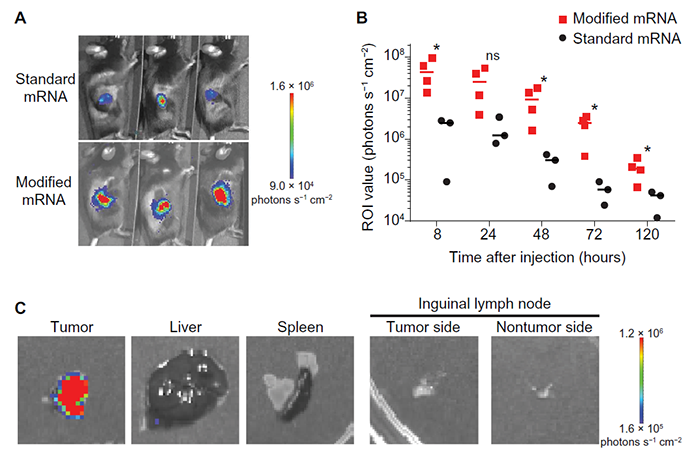
图1. 肿瘤内注射mRNA能够实现蛋白翻译。
在证明了瘤内mRNA递送的可行性后,研究人员测试了在肿瘤内表达免疫调节蛋白的治疗潜力。通过体内抗肿瘤活性筛选,研究人员选择了一种编码四种细胞因子(IL-12sc、GM-CSF、IFN-α和IL-15 sushi)的mRNA混合物。通过多次的瘤内注射细胞因子mRNA混合物,两种小鼠模型中的肿瘤生长得以有效控制,并且大多数肿瘤实现了完全的消退(图2)。
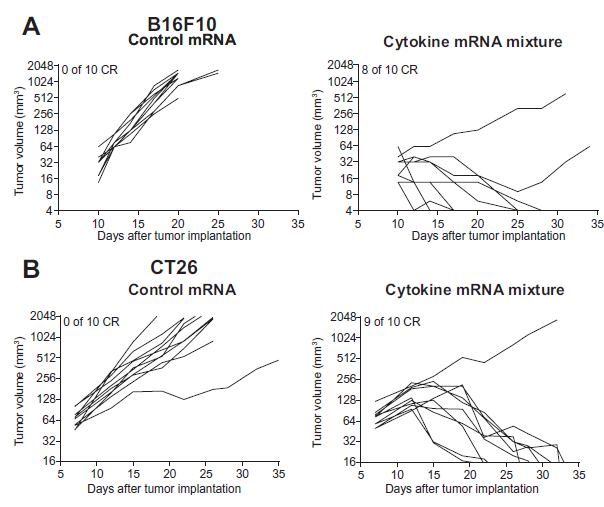
图2. 瘤内注射编码炎症因子的mRNA能够促进肿瘤消退。
为了验证这些细胞因子的表达是否重塑了肿瘤中的免疫微环境,研究人员通过免疫荧光和流式检测发现,细胞因子mRNA的递送显著促进了CD4+和CD8+ T细胞的浸润(图3)。此外,研究人员表明,局部的细胞因子mRNA治疗还能够控制转移模型中的远端肿瘤负担。进一步的结果发现,人类mRNA编码的细胞因子也能够在小鼠体内有效翻译,并在体外分离的癌症患者外周血单核细胞(PBMC)中引起免疫反应。
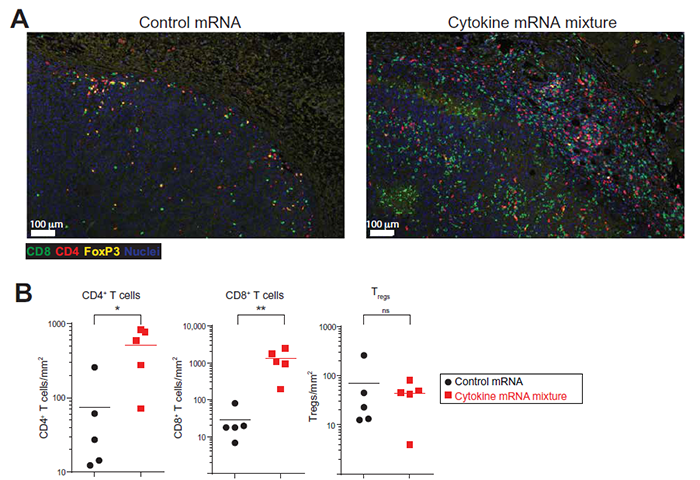
总之,这项工作发现,在多种肿瘤模型中,瘤内注射编码四种不同细胞因子的mRNA能够诱导有效的效应性T细胞反应和针对多种抗原的保护性免疫记忆。这种保护性反应也出现在原发组织以外的转移灶点中,并在耐药模型中与免疫检查点阻断法协同作用。最后,人类特异性mRNA编码的细胞因子被证明在体内表达,并在晚期癌症患者的PBMC中诱导下游药效反应。此外,评估这种细胞因子编码mRNA的临床测试最近也已经启动(NCT03871348)。
参考文献
1. M. Chawla-Sarkar et al., Clin. Cancer Res. 7, 1821–1831 (2001).
2. R. M. Spaapen et al., J. Immunol. 193, 4254–4260 (2014).
3. S. Hervas-Stubbs et al., Clin. Cancer Res. 17, 2619–2627 (2011).
4. G. Fyfe et al., J. Clin. Oncol. 13, 688–696 (1995).
5. J. M. Kirkwood et al., J. Clin. Oncol. 14, 7–17 (1996).
6. T. M. Herndon et al., Oncologist 17, 1323–1328 (2012).
7. P. Berraondo et al., Br. J. Cancer 120, 6–15 (2019).
8. J. R. Quesada et al., J. Clin. Oncol. 4, 234–243 (1986).
9. M. R. Zaidi et al., Clin. Cancer Res. 17, 6118–6124 (2011).
10. J. Cohen, Science 270, 908 (1995).













