促黄体激素和绒毛膜促性腺激素是与促卵泡激素和促甲状腺激素有关的糖蛋白激素。促黄体激素和绒毛膜促性腺激素对人类生殖至关重要,是重要的治疗药物。它们通过与大的细胞外结构域结合来激活相同的 G 蛋白偶联受体,即促黄体激素-绒毛膜促性腺激素受体 (LHCGR)。
2021年9月22日,中国科学院上海药物研究所徐华强/蒋轶课题组,联合浙江大学张岩课题组,共同在Nature 杂志上发表了最新研究成果“Structures of full-length glycoprotein hormone receptor signaling complexes”,首次解析了全长LHCGR处于多种激活状态和失活状态下共四个结构。该项工作揭示了CG与LHCGR相互作用的细节模式,阐明了决定LHCGR和FSHR对于CG,LH以及FSH选择性的关键氨基酸残基,并揭示了受体从失活状态到激活状态的结构变化,提出了激素配体激活受体的结构模式图,并进一步揭示了处于1期临床实验的小分子化合物Org43553与受体LHCGR相互作用细节模式,为临床开发替代激素治疗的小分子药物提供结构依据。

激素是人体的化学信使,控制着各个器官的生理功能。下丘脑和脑下垂体是内分泌激素的控制中心。传统内分泌系统由三大分支组成:下丘脑-垂体-性腺轴(HPG);下丘脑-垂体-甲状腺轴(HPT)和下丘脑-垂体-肾上腺轴(HPA)。其中HPG轴主要调控人体的性别发育,精子发生和卵子成熟,促进第二性特征的发育及维持;HPT轴主要调控机体甲状腺素的水平从而调节人体代谢;而HPA轴主要参与控制应激等许多身体活动,如消化,心情和情绪等。糖蛋白激素主要包括三种促性腺激素,促黄体生成素(luteinizing hormone,LH),促卵泡激素(follicle-stimulating hormone,FSH)和绒毛膜促性腺激素(chorionic gonadotropin,CG),以及第四种促甲状腺激素(thyroid-stimulating hormone, TSH),参与调控HPG轴和HPT轴的生理功能。糖蛋白激素作用于细胞膜受体来发挥其生物学功能,该类激素均为临床重要的治疗药物,其中FSH和LH用于辅助生殖及体外受精,以及治疗女性不孕症和男性促性腺功能减退症等;CG用来诱导女性排卵,增加男性精子数量等。TSH与131I联合应用于甲状腺癌术后患者,抑制和消融残余癌组织等1。尽管几十年来糖蛋白激素的临床应用取得了成功,年销售额达数十亿美元,但糖蛋白激素如何激活人体细胞中的受体机制仍然未知。四种糖蛋白激素在三维结构上非常相似,他们由两条链(α,β)构成,共享α链,而由特异的β链来决定受体的选择性。糖蛋白激素受体为A类G蛋白偶联受体(G protein-coupled receptor, GPCR),其中,LH和CG共同作用于促黄体生成素/绒促性素受体(LHCGR),FSH作用于卵泡刺激素受体(FSHR),TSH作用于促甲状腺激素受体(TSHR)来发挥生理功能。糖蛋白激素受体与大多数A类GPCR不同的是,其具有巨大的N端胞外区结构域(ECD),约由340-420个氨基酸构成,该结构域由富含亮氨酸的重复序列构成,且存在复杂的糖基化修饰,铰链区连接受体的胞外端和跨膜区构成全长受体(图1)。2005年Wayne A. Hendrickson研究组首次解析了FSH 和FSHR的N端(1-268)胞外段的复合物晶体结构,揭示了FSH与受体相互作用的细节模式,同时他们提出了该受体在细胞膜表面可能以双体(dimer)的形式被激活进而发挥生理功能2。随后,在2012年,Xiaolin He 研究组解析了FSH与FSHR完整胞外域的复合物晶体结构,进一步揭示了连接受体胞外端和受体跨膜结构域的铰链区在激素识别和受体激活过程中发挥的重要作用,同时,文章中首次提出了糖蛋白激素受体的激活模型,并认为三聚体形式可能是受体发挥生理功能的状态3。由于糖蛋白激素受体结构的特殊性,使得体外表达纯化该类全长受体非常困难,从而极大地限制了人们对于该类受体的激素选择性,以及激活机制的研究。同时,结构信息的缺乏也成为了靶向该类受体的小分子治疗药物研发的瓶颈。研究团队采用单颗粒冷冻电镜技术,首次解析了3个近原子分辨率的全长LHCGR处于激活状态下的结构(图1):分别是结合内源性激素CG的LHCGR(野生型)受体结构(4.3 Å)、结合内源性激素CG的LHCGR(含持续性激活突变S277I)受体结构(3.8 Å)以及结合内源性激素CG和小分子化合物Org43553的LHCGR(含持续性激活突变S277I)受体结构(3.2 Å)。
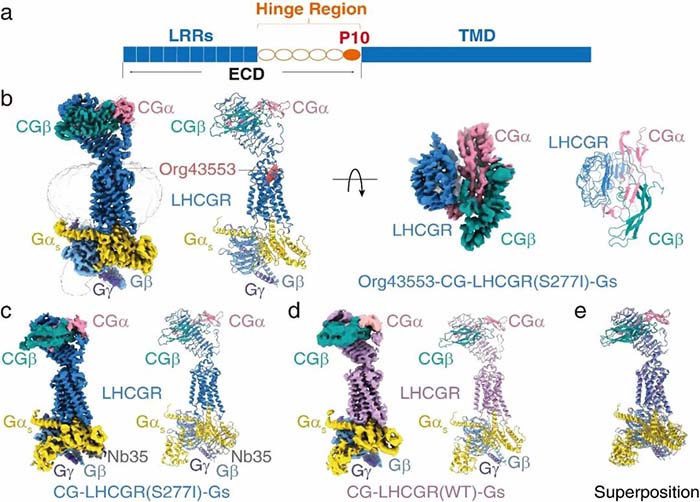
图1-糖蛋白激素结构模式图及LHCGR受体与CG和Gs蛋白复合物的冷冻电镜结构
该研究首次揭示了LHCGR的全长结构,以及CG与LHCGR相互作用的细节模式。LHCGR的ECD包含11个不规则的亮氨酸折叠片,形成一个弯曲的马蹄形结构,铰链区包含一个α螺旋和第10和11亮氨酸折叠片,CG主要与受体的ECD上端结合,通过类似一种手扣手的方式与受体凹面内表面结合,CG表面与受体内表面形成电性互补。通过对比FSH/FSHR_ECD的结构,研究人员首次揭示了决定LHCGR和FSHR 对于LH,CG,FSH选择性关键结构域(图2)。
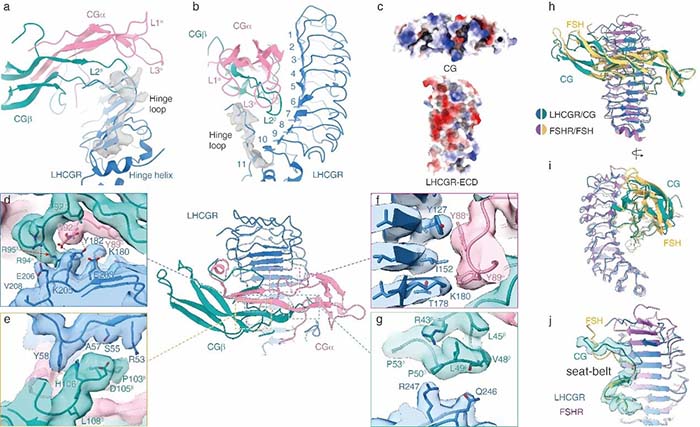
图2-LHCGR受体与CG相互作用细节以及与FSH/FSHR_ECD结构比较
为进一步了解LHCGR的激活机制,研究人员通过大量尝试,最终解析了全长LHCGR处于失活状态下的电镜结构,分辨率为3.8 Å。通过对比处于失活状态和激活状态下的LHCGR,研究人员发现受体的ECD部分发生了大约45度的偏转,进一步通过结构分析和功能试验验证,最终提出了LHCGR受体“push and pull”的结构激活模型。这也是第一个全长单独GPCR的电镜结构。
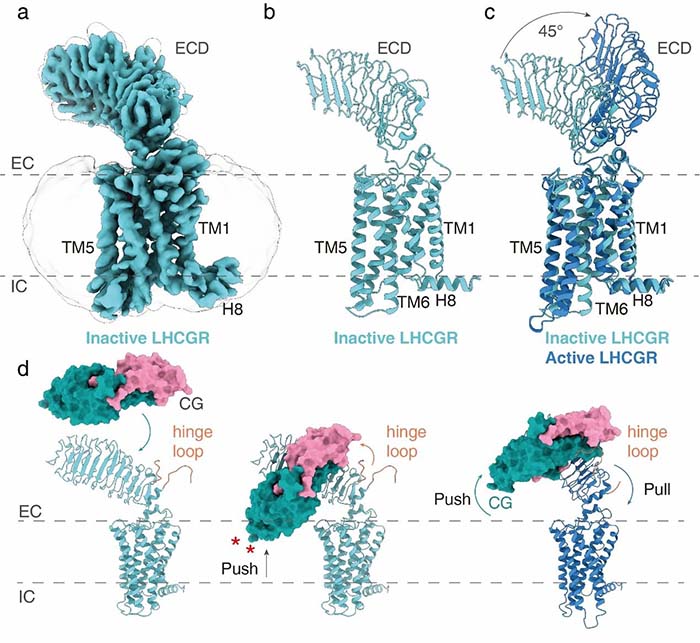
图3-LHCGR失活状态电镜结构与激活状态结构比较以及受体激活模型
从结构中,我们可以看出,CG主要与受体的胞外区结合,那么受体又是如何与激素配体结合后将这种激活信号向下传递至跨膜区的呢?通过结构分析可以看出,受体ECD与跨膜区相互作用的界面主要有两个,其一是受体的铰链区α螺旋与受体胞外loop 1 (ECL1)之间,其二是受体铰链区的C末端与受体的跨膜区上部形成广泛的相互作用。铰链区的C末端存在着10个保守的氨基酸残基(P10),在三个糖蛋白激素受体中完全相同,这十个氨基酸对于受体的激活十分重要,也从侧面反映糖蛋白激素受体结构及激活机制的保守性。
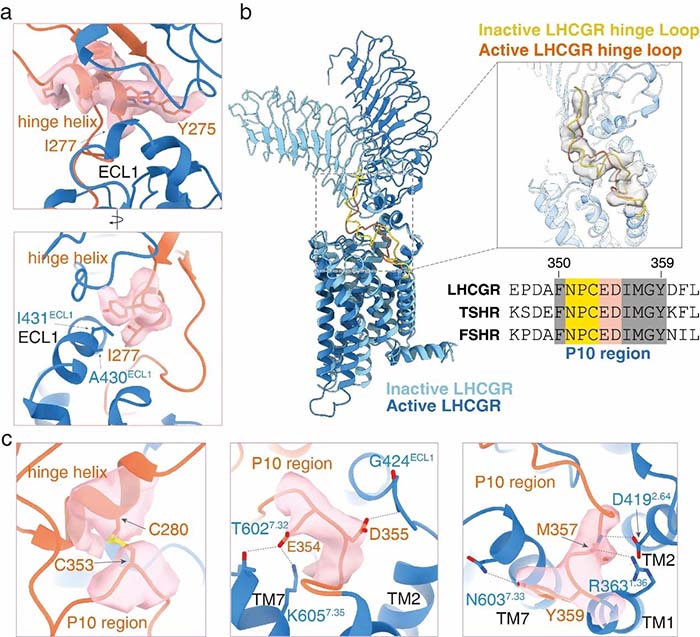
图4-LHCGR激活信号从受体胞外端向跨膜区传递界面
另外,研究人员还解析了处于1期临床实验中的小分子化合物Org43553与LHCGR相互作用的细节模式,揭示了Org43553的结合口袋,为临床开发针对LHCGR,FSHR,以及TSHR的选择性小分子化合物替代激素治疗提供了结构模板。
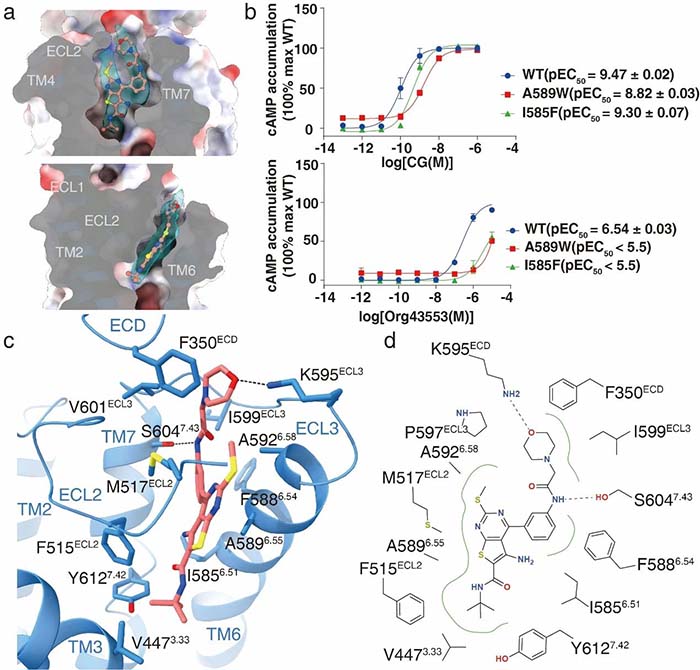
图5-Org43553与LHCGR相互作用细节
综上,本研究首次揭示了LHCGR的全长结构,揭示了LHCGR与其内源性激素配体CG的相互作用模式,揭示了LHCGR和FSHR对于三种激素LH,CG,FSH的选择性问题,同时,也阐释了LHCGR的结构激活模型,鉴于糖蛋白激素受体结构的保守性,该激活模型同样适用于两外两种受体。最后,本研究进一步揭示了小分子化合物Org43553与受体LHCGR相互作用的细节模式,为靶向糖蛋白激素受体的小分子药物开发提供了结构基础。

本课题由中国科学院上海药物研究所徐华强/蒋轶研究团队联合浙江大学张岩团队,精诚合作,合力攻关,并在中国科学院上海药物研究所蒋华良院士、清华大学协和医院张抒扬教授,以及英国剑桥大学Tristan Croll的协助下完成。上海药物研究所博士生段佳、徐沛雨、浙江大学基础医学院附属邵逸夫医院毛春友研究员,上海药物研究所程曦副研究员为本文共同第一作者。该工作得到国家重点研发计划、上海市市级科技重大专项、科技部重点研发计划、中科院战略性先导科技专项、国家自然科学基金委及浙江省自然基金委等项目的资助。1 Jiang, X., Dias, J. A. & He, X. Structural biology of glycoprotein hormones and their receptors: insights to signaling. Mol Cell Endocrinol 382, 424-451, doi:10.1016/j.mce.2013.08.021 (2014).2 Fan, Q. R. & Hendrickson, W. A. Structure of human follicle-stimulating hormone in complex with its receptor. Nature 433, 269-277, doi:10.1038/nature03206 (2005).3 Jiang, X. et al. Structure of follicle-stimulating hormone in complex with the entire ectodomain of its receptor. Proc Natl Acad Sci U S A 109, 12491-12496, doi:10.1073/pnas.1206643109 (2012).
https://www.nature.com/articles/s41586-021-03924-2




















