AMPK(AMP-activated protein kinase)是细胞内最重要的能量感受器和调节器,可感知能量状态变化并作出响应,调节多种代谢活动来维持能量生成与消耗的供需平衡,其底物涉及细胞生长、繁殖和代谢过程中的多种关键酶和转录调控因子,因此AMPK功能失常与代谢类疾病如糖尿病、肥胖等,以及癌症的发生都有密切的关系。
美国温安洛研究所(Van Andel Institute)Karsten Melcher课题组,与包括中国科学院上海药物研究所徐华强等多个课题组合作,于北京时间2021年7月23日以Structure of an AMPK complex in its inactive, ATP-bound state 为题在Science在线发表了关于腺苷酸活化蛋白激酶(AMPK)的重要研究成果(闫焱博士为第一作者)。该团队利用Cryo-EM 技术首次解析了ATP结合状态下的抑制型AMPK复合物的高分辨率结构,阐述了AMPK的活性调节机制,提出了AMPK激活、失活、再激活的循环通路模型。

作为调节能量代谢的开关,AMPK的活性受到细胞能量水平,即腺嘌呤核苷酸(AMP、ADP和ATP)水平的影响。低能状态下,AMP诱导AMPK激活,反之,能量过剩时,ATP竞争性地取代AMP以抑制AMPK活性。虽然AMP结合下的激活型AMPK晶体结构早已解析,但由于ATP结合下的抑制型AMPK具有高度动态性,该结构的解析工作极具挑战且困扰了科学家们长达二十多年之久。也正是由于结构信息的缺乏,目前AMPK的活性调节机制尚不明晰,很大程度上阻碍了药物发现的进程。
为了攻克这一难题,美国温安洛研究所Karsten Melcher课题组联合合作团队,首先利用噬箘体展示技术正向筛选了对ATP结合的抑制型AMPK具有高亲和力的抗体,再用AMP结合的激活型AMPK进行反向筛选,排除了结合激活型AMPK的抗体,由此得到了高特异性结合抑制型AMPK的抗体以稳定整个复合物。利用温安洛先进的冷冻电镜技术,研究团队终于成功解析了ATP结合状态下的抑制型AMPK复合物近原子分辨率的冷冻电镜结构。令人惊讶的是,该结构显示了完全不同于激活型AMPK的催化结构域(Kinase Domain,即KD)构象,即空间上进行了180°的旋转和100 Å的位移,导致活化环(Activation loop,即AL)充分暴露,且处于非磷酸化的状态。基于此结构和后续大量的生化分析,该团队提出了一个多步骤机制模型,揭示了腺嘌呤核苷酸和药物激动剂如何通过改变活化环的磷酸化水平和可及性来调节AMPK活性的全过程。
AMPK是由α、β、γ三亚基组成的异源三聚体复合物,位于α亚基催化结构域上的活化环AL包含一个核心磷酸化位点,即α1第174位的苏氨酸(T174)(或α2的T172)。T174的磷酸化会引导AL形成正确构象以完成将磷酸基团从ATP向底物多肽转移的过程,因此T174的磷酸化状态是AMPK活化与否的重要标志。位于 γ亚基上的CBS3是能量感知位点,可根据能量变化竞争性地结合AMP、ADP或ATP。从激活型AMPK的构象得知,CBS3与AMP结合,且T174被磷酸化,α亚基催化结构域(KD)与β亚基碳水化合物结合域(CBM)相互作用,此时AL处于 “被包裹” 的状态而受到高度保护,因此蛋白磷酸酶难以靠近;而抑制型AMPK的构象则显示,CBS3被ATP占据,且T174未被磷酸化,令人惊讶的是,此时KD完全脱离了与CBM的作用,整体进行了180°的旋转和100 Å的位移,AL完全暴露在外,使得上游激酶和蛋白磷酸酶能够轻易靠近它以实现磷酸化或去磷酸化反应。
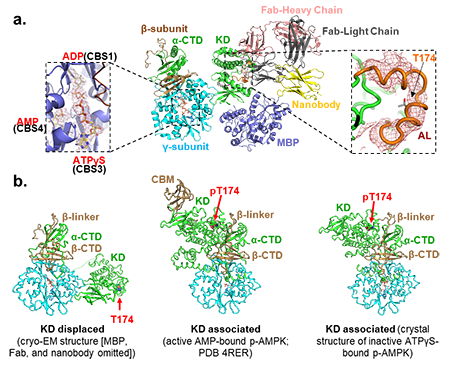
研究团队开展了一系列分子水平的实验分析,验证了AMPK从激活型到抑制型的构象转变,并证明了造成此变化的“开关”正是AL的去磷酸化。体外相互作用(ALPHA Screen)显示,非磷酸化AMPK的KD与γ亚基N端的距离明显小于磷酸化的AMPK,且AMP进一步缩短、ATP则加长了非磷酸化AMPK中两位点间的距离,却不影响磷酸化状态的AMPK,此现象可能与AMP引导的后续LKB1激酶结合AMPK以使其重新磷酸化的过程有关。基于蛋白质交联质谱(XL-MS)的分析结果也验证了AMP结合的、磷酸化的AMPK为“KD联结”(KD-associated)构象,而ATP结合的、非磷酸化的AMPK则为“KD脱离”(KD-displaced)构象。氢/氘交换质谱(HDX-MS)实验则进一步证明了引起KD构象转变的直接因素是AL的磷酸化状态变化,而非CBS3位点AMP与ATP的置换。为了进一步阐述ATP引导去磷酸化的机制,研究团队对AMPK的多部位进行了突变分析,结果显示β亚基N端CBM和C端支架结构域(CTD)之间的连接区(β-linker)是使AL受到保护的关键,起到类似“护盾”的作用,而后续的突变分析和氢/氘交换质谱分析进一步显示,AMP结合后形成的“CBS3/α-linker/R365结合口袋”以及药物激动剂结合后形成的“KD/CBM/C端互作螺旋”两种静电相互作用网络均提高了β-linker的稳定性,进而稳定了“KD联结”构象,保护了AL不被磷酸酶去磷酸;相反,ATP干扰了AMP形成的作用网络,降低β-linker的稳定性而使AL更容易被去磷酸。
此外,研究团队还开展了细胞水平的AMPK构象转变分析,用高糖诱导细胞从低能量状态向能量过剩状态进行转变。在此过程中,利用生物发光共振能量转移(BRET)技术检测了AMPK分子内两个被标记氨基酸的距离变化,该结果验证了AMPK经历了从“KD联结”向“KD脱离”的构象转变;同时,利用蛋白质免疫印迹法(WB)和液相串联质谱法(LC-MS)分别检测了该过程中AMPK和其底物的磷酸化状态变化以及腺嘌呤核苷酸水平的变化,结果显示,仅在高糖处理15分钟后,AMPK及其底物ACC的磷酸化水平就显著降低,同时细胞内AMP/ATP、ADP/ATP的比值均显著降低,这些现象与AMPK的构象转变高度一致。
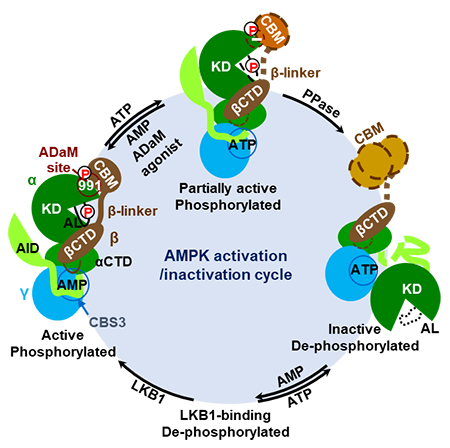
由此,研究团队提出了AMPK从激活、失活到再激活的完整循环通路模型。完全激活状态下的AMPK、KD和CBM均被磷酸化,AMP和药物激动剂通过与β-linker两侧区域形成静电相互作用网络而提高了β-linker的稳定性。而能量过剩时,高水平的ATP取代AMP结合在CBS3处,削弱了相互作用网络从而破坏了β-linker和KD的活性构象,导致AL对磷酸酶的可及性增加。故在此“半激活” 状态下,AL/β-linker和CBM/KD相互作用的去稳定化会进一步增加AL和CBM的去磷酸,导致KD与CBM脱离并发生大幅度位移,造成AMPK的完全抑制。而当细胞再次进入低能状态时,AMP重新取代CBS3处的ATP,诱导AMPK的某种构象变化促使上游激酶LKB1对AMPK的AL再度磷酸化。
美国温安洛研究所的博士后闫焱为本文的唯一第一作者,Karsten Melcher教授为通讯作者。同时,该课题获得了包括中科院上海药物研究所徐华强(H. Eric Xu)课题组、美国芝加哥大学Anthony A. Kossiakoff课题组、美国Scripps研究所Patrick R. Griffin课题组和美国梅奥诊所医学中心Laurence J. Miller课题组的大力支持。
来源:bioart













