近日,来自美国西奈山医学院的Miriam Merad团队在Nature杂志在线发表了题为Tissue-resident macrophages provide a pro-tumorigenic niche to early NSCLC cells的研究论文,通过单细胞测序、谱系追踪、3D共培养等技术对巨噬细胞在非小细胞肺癌(NSCLC)中的作用进行了系统研究,发现了TRM在早期肺癌中的关键作用,从而帮助我们鉴定肿瘤治疗新靶标并开发早期肺癌干预策略。

首先,研究人员利用开放的单细胞测序数据库【1】,对35名NSCLC患者局灶部位及未浸润部位的肺部样品进行了分析,将巨噬细胞和单核细胞进行了细致分类 (图1)。其中Group I细胞亚群为具有自我更新潜能的TRM,被认为是肺泡巨噬细胞。随后研究人员使用小鼠肺腺癌模型进行单细胞测序(图1),发现了与人类NSCLC组织表达相似基因的巨噬细胞亚型Group I,因此,这种跨物种研究揭示了该细胞亚型具有同源巨噬细胞表型的特征。
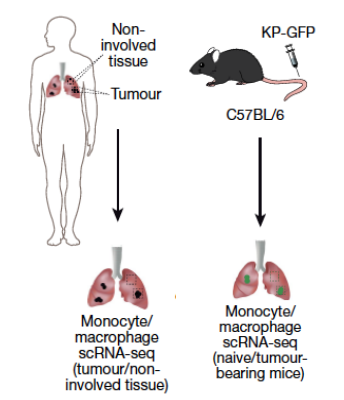
图1. 骨髓移植实验设计,将年轻小鼠(2月龄)与中年小鼠(9-12月龄)进行LT-HSC移植
为使用该小鼠模型揭示肿瘤相关巨噬细胞亚型的谱系来源,研究人员使用他莫昔芬诱导型的Map17CreER及Cx3cr1CreER等多个转基因小鼠品系与报告基因小鼠杂交,确定了Group I细胞亚群来源于组织特异巨噬细胞,因此命名Group I亚群细胞为TRM,而其他细胞则命名为MDM (单核细胞来源巨噬细胞)。为研究TRM亚群细胞的分子特征,研究人员对此前inDrop单细胞测序的数据【2】进行分析,验证了TRM亚群细胞与血液来源的巨噬细胞具有显著不同的分子特征。
为研究TRM巨噬细胞如何塑造NSCLC肿瘤微环境,研究人员使用RNA测序对肿瘤细胞植入后TRM的动态分子特征进行了研究,发现了在肿瘤植入早期,TRM可上调及下调特定基因群,并鉴定了特定通路。使用ATAC-seq对TRM在早期肿瘤线索中的转录组响应进行研究,研究人员发现TRM在早期肿瘤植入后并未出现显著转录组响应,而大部分转录组变化与抗原提呈及组织器官重构相关。为研究肿瘤细胞与TRM的相互作用如何影响TRM,研究人员使用三维共培养系统,揭示了TRM可在肿瘤进程的早期促进肿瘤侵袭并影响组织器官重构。
研究人员还发现,TRM可通过上调CD73及CTLA-4在Treg细胞的表达从而促进Treg细胞分化,并进一步促进其早期扩张。使用白喉毒素受体工具小鼠以耗竭TRM,研究人员发现肿瘤早期局灶部位的Treg细胞数量显著降低,且表达CD73及CTLA-4的Treg细胞也显著降低,同时也伴随着肿瘤大小的降低 (图2)。
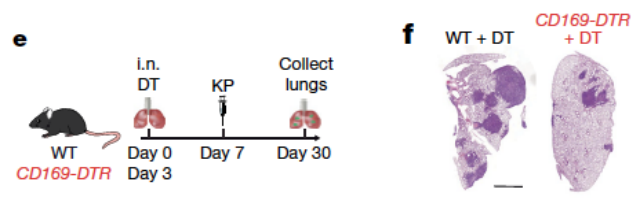
图2. 耗竭TRM可降低肿瘤符合及T细胞浸润
组织特异巨噬细胞及单核细胞来源的巨噬细胞均存在于肺癌早期病灶部位,在进展至肺癌晚期后仍具有显著不同的病理表型及分子特征。本文通过单细胞测序、成像、三维共培养、条件性耗竭等技术,发现肿瘤细胞植入肺组织后,TRM随之聚集并诱导上皮间质转化从而促进肿瘤侵袭性,同时促进Treg细胞的响应,进而揭示了组织特异巨噬细胞在肿瘤早期进程的关键作用(图3)。这些结果证明,组织特异巨噬细胞为肿瘤进程提供了完美的微环境,因此,这些组织特异巨噬细胞可作为干预早期肺癌的重要靶标。
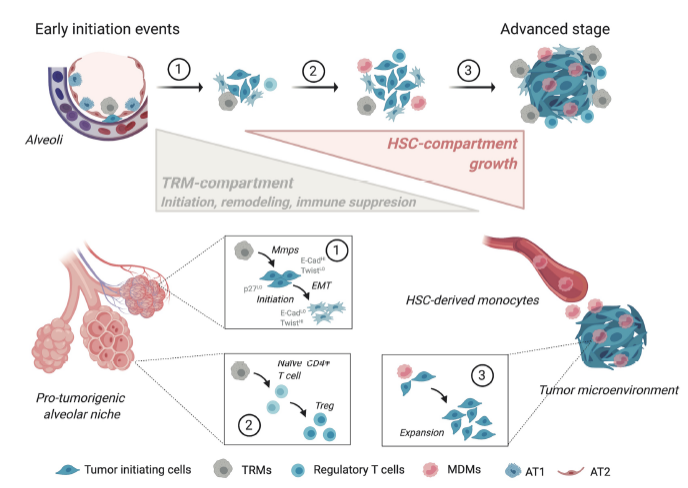
图3. TRM及MDM对肿瘤进程的不同作用
原文链接:
https://doi.org/10.1038/s41586-021-03651-8
[1] Leader, A. M. et al. CITEseq analysis of non-small-cell lung cancer lesions reveals an axis of immune cell activation associated with tumor antigen load and TP53 mutations. Preprint at https://doi.org/10.1101/2020.07.16.207605 (2020).
[2] Zilionis, R. et al. Single-cell transcriptomics of human and mouse lung cancers reveals conserved myeloid populations across individuals and species. Immunity 50, 1317–1334 (2019).













