头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)是一种世界范围内的高度恶性肿瘤,其五年存活率低,预后效果差。鳞状细胞癌(Squamous cell carcinoma,SCC) 具有侵袭性,也常发生于皮肤,肺与食道。在 SCC 发展过程中,多种致癌基因和信号通路被激活,细胞周期检查点失调。
最近的研究表明,靶向 PD1/PD-L1 和 CTLA4 的免疫检查点抑制剂在多种实体瘤如黑色素瘤和头颈部鳞状细胞癌中取得了良好的疗效。虽然抗 PD1 疗法已经被批准用于治疗复发性或转移性鳞状细胞癌,但是实际缓解率却低于 20%。针对正在进行的癌症免疫治疗来说,提高 SCC 细胞的免疫原性变得越来越重要。然而,对于提高鳞状细胞癌的免疫治疗效果来说,目前发现的易感性靶点却太少了。

图片来源:Molecular Cell
2021 年 3 月 19 日,加州大学洛杉矶分校,中国工程院外籍院士王存玉团队在 Molecuar Cell 上发表题为 Targeting KDM4A epigenetically activates tumor-cell-intrinsic immunity by inducing DNA replication stress 的研究成果。
图片来源:Molecular Cell
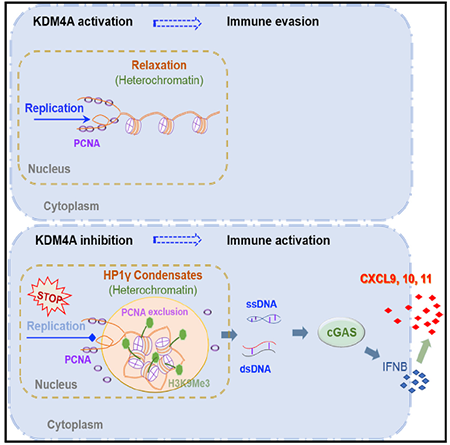
研究表明,抑制 KDM4A 促进了异染色质的压缩,并诱导了 DNA 复制压力,从而引发了 SCC 的抗肿瘤免疫。抑制 KDM4A 与阻断 PD1 协同作用,通过招募和激活 CD8+T 细胞来抑制鳞状细胞癌的生长和转移。
研究内容
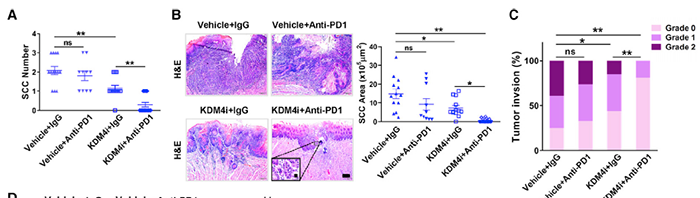
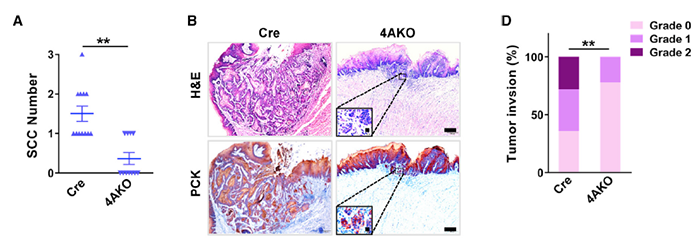
敲除 Kdm4a 在体内抑制了 SCC 的侵袭和转移
KDM4A 作为组蛋白 H3 第 9 位赖氨酸(H3K9me3)的去甲基化酶,在调控鳞状细胞癌的生长和转移过程中发挥着重要的作用。为了证明 KDM4A 是鳞状细胞癌的重要治疗靶点,研究人员在敲除小鼠 Kdm4a 基因并利用 4-NQO(4-Nitroquinoline N-oxide)诱导的细胞癌模型,探究 KDM4A 基因缺失是否能抑制细胞癌的生长和转移。
组织学分析显示,上皮细胞特异性缺失 Kdm4a 显著降低了 SCC 的数量,而非异常增生的数量,表明 KDM4A 促进了体内异常增生向 SCC 的致癌转化。并且泛细胞角蛋白免疫组化染色表明在 KDM4A 缺失后 SCC 的面积和肿瘤侵袭程度均显著降低。
图片来源:Molecular Cell
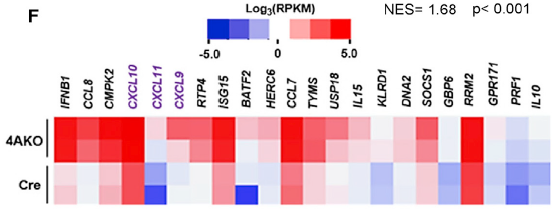
肿瘤细胞 KDM4A 缺失刺激抗肿瘤免疫和抑制肿瘤干细胞形成
为了探究 KDM4A 缺失改善小鼠原发性 SCCs 的机制,研究人员对 KDM4A 缺失后 SCCs 进行了全转录组分析。RNA-seq 分析发现,与 KO 鼠相比,免疫应答相关基因显著上调,GO 与 GSEA 显示,I 型干扰素(IFN)的产生和信号转导是最显著的上调过程之一。同样缺失激活了 Th1 型细胞毒素免疫,免疫相关 CXCL9,CXCL10 和 CXCL11 表达显著升高。
图片来源:Molecular Cell
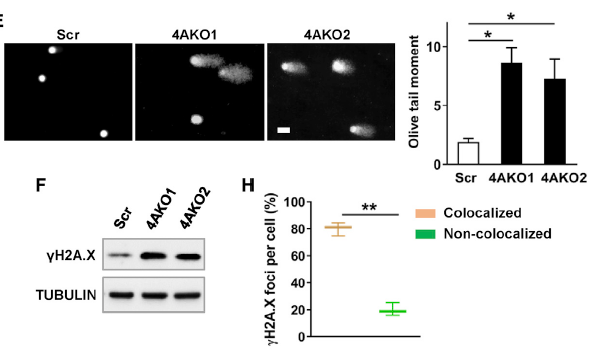
抑制 KDM4A 诱导复制压力和 DNA 损伤
免疫共沉淀发现 KDM4A 与 SCC 细胞中微染色体维护蛋白 2(mini-chromosome maintenance protein,MCM2)、MCM7 互作,表明 KDM4A 可能与 DNA 复制或者相应的损伤修复相关。为了验证这一猜想,研究人员测定了 DNA 复制率和停滞叉数,发现敲除细胞中复制叉形成速率比对照组降低了 50%,而停滞复制叉的数量则增加了 3 倍。这些结果表明 KDM4A 缺失严重阻碍了 DNA 复制,从而导致 SCC 细胞的复制压力。此外,彗星电泳实验和 DNA 损伤位点标志蛋白 γH2AX 检测证明敲除 KDM2A 明显增加了肿瘤细胞的 DNA 损伤数量。
图片来源:Molecular Cell
复制压力激活 cGAS-STING 信号和肿瘤固有免疫应答
细胞核内的复制压力和 DNA 损伤会导致 DNA 片段在胞质积累。研究人员发现敲除 KDM4A 增加了细胞内的 ssDNA 和 dsDNA 片段。胞质内积累的 DNA 片段会激活 cGAS-STING 信号途径,导致激活干扰素刺激基因包括 Th1 型趋化因子 CXCL9,CXCL10 和 CXCL11。KDM4i 作为一种化学抑制剂,可以有效抑制 KMD4 家族蛋白表达。为了开发癌症免疫治疗中的 DNA 复制应激反应,研究人员探究了抑制 KDM4A 是否可以诱导 Th1 型趋化因子的表达。结果发现 KDM4i 处理也可以刺激 IFNB、CXCL9、CXCL10 和 CXCL11 的表达。
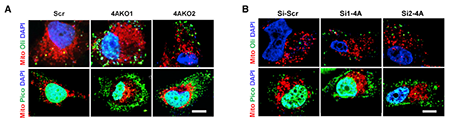
图片来源:Molecular Cell
KDM4A 缺失抑制 SCC 需要 CXCR-3 介导的 CD8+T 细胞浸润
趋化因子配体 CXCL9,CXCL10 和 CXCL11 激活 CXCR3,从而招募 CD8+T 细胞进入肿瘤体。既然 KDM4A 缺失导致趋化因子表达升高,研究人员进一步探究体内 CXCR3 介导的 CD8+T 细胞浸润是否与 SCC 衰退有关。通过在 SCC 诱导第 20 周,同时使用 taximofen(清除肿瘤细胞 KDM4A)和抗 CXCR-3 中和抗体,免疫荧光染色发现抗 CXCR3 治疗显著减少了敲除小鼠中的 CD8+T 细胞数量,而敲除鼠中 SCCs 数量显著增加。此外,抗 CXCR3 治疗显著损害了 KDM4A 缺失改善的淋巴结转移。这些结果表明,KDM4A 缺失抑制 SCC 生长和淋巴结转移是通过招募和激活 CD8+T 细胞来实现的。
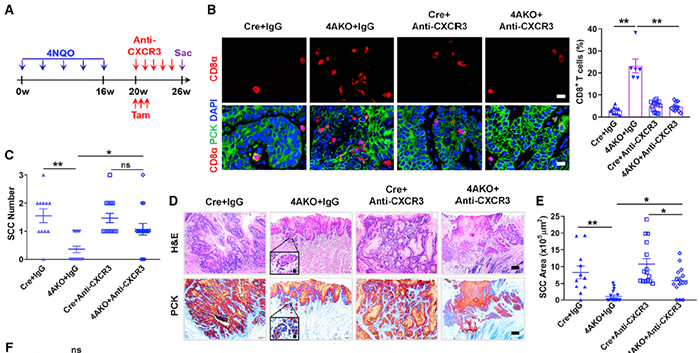
图片来源:Molecular Cell
靶向 KDM4A 克服 PD1 阻断治疗耐受和消除小鼠肿瘤干细胞
临床和小鼠实验数据证明,新 CD8+T 细胞在肿瘤内浸润决定了 PD1 阻断治疗的响应和癌症治疗的疗效。由于 KDM4A 缺陷诱导肿瘤细胞固有免疫应答,从而招募 CD8+T 细胞进入小鼠原发性鳞状细胞癌,因此研究人员推测 KDM4A 的抑制可能增强了体内 PD1 阻断的效果。
为了证明这一假设,团队采用了 KMD4i 和 PD1 中和抗体联合治疗。结果发现,与 KDM4A 缺失一致,KDM4i 治疗显著减少了 SCC 数量,大小和侵袭程度。尽管 PD1 阻断不影响 SCC 生长,但是与 KDM4i 联合使用显著减少 SCC 数量,大小和侵袭程度。此外,KDM4i 治疗显著诱导了 SCCs 凋亡与增加 CD8+T 细胞浸润,而联合使用 KDM4i 与 PD1 中和抗体诱导了更多 SCCs 的凋亡和 CD8+T 细胞。这些结果表明通过激活和招募 CD8+T 细胞,KDM4A 抑制克服了 SCC 细胞对 PD1 阻断的固有耐受。为了进一步证明这一结论,研究人员在 CXCR3 中和抗体存在的情况下,测试 KDM4i 是否能加强 PD1 抗体抑制 SCC 的生长与转移。与 KDM4i 和抗 PD1 单独治疗相比,抗 CRCX3 治疗显著消除了联合使用招募的 CD8+T 细胞。在抗 CXCR3 存在情况下,KDM4i 和抗 PD1 联合使用无法抑制 SCC 的生长与转移。
为了排除 KDM4i 的非特异性,研究团队又在 KDM4A 敲除小鼠中使用 PD1 阻断治疗,结果表明 PD1 阻断显著减少了 SCC 的数量,面积和侵袭程度。
图片来源:Molecular Cell
研究总结
开发激活肿瘤细胞固有免疫应答的策略对于提高肿瘤免疫治疗是至关重要的。已发现 KDM4A 在 SCC 的生长和转移中发挥重要作用。本研究发现抑制 KDM4A 促进异染色质上液体状 HP1γ 斑点的形成,阻碍了 DNA 复制,从而通过复制压力诱导细胞内 DNA 积累,激活肿瘤细胞固有的 cGAS-STING 信号。
此外,KDM4A 抑制与 PD1 阻断协同作用,通过激活和招募 CD8+ T 细胞来抑制鳞状细胞癌的生长和转移。本研究表明靶向 KDM4A 可能为联合治疗抑制肿瘤的生长和转移提供新思路。













