“终于有我们自己的基因编辑工具了”,相信这是国内从事基因编辑相关基础和转化应用研究的同行最大的期盼。Cas13X是目前报道最小的RNA编辑工具,即可以做RNA敲降,又可以做RNA修复、RNA剪切,一个AAV就可以包下,效率、特异性都比RNAi、ASO要好很多。据了解,今后杨辉实验室的重心都会聚焦于Cas13X的进一步优化和应用上面。基因治疗应用于临床的三大要素,效率、脱靶、递送,这项工作只是解决了递送问题。体内编辑效率的进一步提高、旁切活性的解决,才能使Cas13X早日应用于临床。这些需要领域内科学家的共同努力。所有RNAi、ASO的药物靶点都是Cas13X的潜在靶点,抗体、小分子、DNA编辑工具的靶点,Cas13X都可以尝试。目前杨辉实验室正在超过10种罕见病、数种常见病上面测试Cas13X的治疗效果,希望Cas13X能够早日成药,造福患者。
CRISPR/Cas13是一类RNA介导的靶向RNA切割的系统,它被广泛地应用于RNA敲低、RNA单碱基编辑、RNA定点修饰、RNA活细胞示踪以及核酸检测领域。相比于传统的RNA干扰技术,Cas13系统具有更高的敲低效率和特异性;而且,相比于Cas9介导的DNA编辑技术,Cas13不会对基因组造成永久性改变,甚至可以通过药物来调控RNA编辑,使其具有可逆性,因此在疾病治疗上具有比较独特的优势。
2015年,美国国家生物技术信息中心的进化生物学家Eugene Koonin实验室和美国Broad研究所的张锋团队合作,利用计算生物学方法在微生物宏基因组数据库中发现了Cas13a(c2c2),Cas13b(c2c6)和Cas13c(c2c7)三种系统【1】,并后续证明了这些系统在哺乳动物细胞中可以对靶RNA进行高效地敲低【2,3】。张锋团队进一步对Cas13和RNA脱氨酶ADAR2进行改造,将其应用于哺乳动物的RNA单碱基编辑【4】。2018年,美国Salk研究所的Patrick D Hsu和Arbor Biotechnologies公司的David A Scott从张锋实验室获得博士学位之后,各自致力于新的Cas13系统的开发。继Eugene Koonin和张锋发现Cas13a/b/c不久,他们分别在Cell和Molecular Cell上同时报道了Cas13d系统【5,6】,相对于之前的系统,Cas13d蛋白减少了100到200个氨基酸。其中, Patrick D Hsu实验室发现的RfxCas13d展现了最佳的敲低效率,加上体积小的优势使得它广受领域内研究者的追捧。虽然RfxCas13d只有967个氨基酸,但是整个系统已接近单个AAV的装载极限了,而基于Cas13d的RNA单碱基编辑工具则更难用单个腺相关病毒 (Adeno-associated virus, AAV) 载体进行递送,因此开发更小的高效的RNA编辑工具对临床转化具有重要意义。
2021年 5 月2日,中科院脑智中心(中科院神经所)杨辉团队在Nature Methods上在线发表了题为Programmable RNA editing with compact CRISPR–Cas13 systems from uncultivated microbes的研究论文。该研究通过对微生物大规模宏基因组数据进行计算分析发现两类新的CRISPR/Cas13系统,通过功能实验和工程化改造开发了一套高效率和高特异性的RNA编辑工具,该工具对开发基于RNA编辑的基因治疗手段具有重要的促进作用。

最近报道的Cas13系统都是从可培养的微生物基因组数据中挖掘的,然而自然界中90%的微生物都是不可培养的,因此,杨辉团队这次把目标聚焦在挖掘未获培养的自然微生物宏基因组数据。该研究通过精巧的计算生物学算法和实验设计,鉴定到了两个新的Cas13家族,并命名为Cas13X和Cas13Y,其中,Cas13X.1蛋白比常用的RfxCas13d蛋白还要小将近200个氨基酸,为目前最小的Cas13蛋白。通过对大量内源基因位点进行RNA敲低实验,Cas13X.1展现了与RfxCas13d同样的高活性和高特异性。为了进一步研究Cas13X.1在抗RNA病毒方面的应用潜力,团队成员分别对H1N1病毒和过表达的部分新冠病毒基因组上多个位点进行靶向切割,发现Cas13X.1在体外展现了良好的病毒抑制效果。最后,杨辉团队将突变的dCas13X.1与ADAR2dd进行融合,并做了一系列蛋白截短改造,开发了一种迷你型的RNA单碱基编辑工具,通过与之前报道的RNA单碱基编辑系统进行比较, 发现基于迷你型Cas13X.1蛋白的RNA单碱基编辑系统(miniCas13X-ADAR2dd)可以对靶RNA进行高效的A到I和C到U的编辑。同时,miniCas13X-ADAR2dd比REPAIR和RESCUE系统【4,7】小将近900aa,可以包装到一个AAV里面。此外,全转录组分析显示,迷你碱基编辑器脱靶活性极低,是一项高保真的碱基编辑技术。值得一提的是,目前Cas13系统应用于临床最大的障碍是Cas13蛋白本身的旁切活性 (collateral activity, 靶RNA激活的非靶标RNA切割活性)。已有证据表明Cas13d的旁切活性会对动物细胞和个体产生一定毒副作用【8,9】。虽然Cas13X.1在体外切割实验中显示了比Cas13a和Cas13d更低的旁切活性,但是将来对Cas13X.1的进一步改进,以及体内的长期安全性评价,对于临床上安全应用Cas13至关重要。
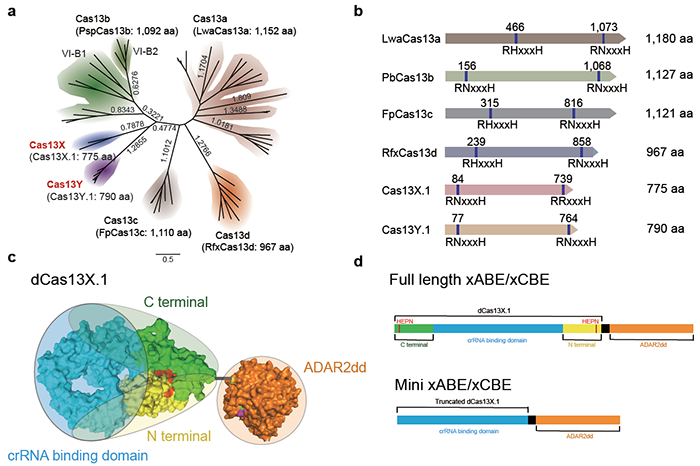
此工作成功地从未获培养微生物宏基因组数据中鉴定到了两个新的Cas13系统,极大地丰富了Cas13家族的多样性。而且通过大量实验证明了Cas13X.1在RNA编辑方面具有非常大的应用潜力,小的尺寸很好的解决了Cas13体内递送的问题,有望在未来成为一种高效和安全的RNA治疗药物,为疾病 (尤其是罕见病) 基因治疗提供了更多的选择。
该项工作由中科院脑智中心博士后胥春龙、周英思和博士研究生肖庆全、博士后贺冰冰与耿冠男等研究人员,在中科院脑智中心杨辉研究员、周英思博士和中国农业大学农学院赖锦盛教授的指导下完成,课题组的博士后汪子康、董雪、研究生曹碧蓉和本科生王一凡等其他成员积极参与,并得到了脑智中心流式分选和高性能计算集群平台的大力协助。
原文链接:
https://doi.org/10.1038/s41592-021-01124-4













