胶质母细胞瘤(GBM)具有高侵袭性、高浸润性、瘤内及瘤间高度异质性的特点 [1],其发达的免疫逃逸机制导致至今仍未出现有效的免疫治疗方案,缺乏免疫活性 GBMs 动物模型也阻碍了对 GBM 及其免疫微环境的研究。
2021 年 4 月 15 日,英国爱丁堡大学再生医学中心的 Steven M. Pollard 团队于 Cell 发表了「Glioblastomas acquire myeloid-affiliated transcriptional programs via epigenetic immunoediting to elicit immune evasion」一文。

图片来源:Cell
该研究中,作者通过连续将神经胶质瘤干细胞(GSCs)移植入免疫活性的宿主,揭示了 GSCs 细胞通过建立免疫抑制肿瘤微环境来获得免疫逃逸能力的机制:GSCs 在受到免疫攻击后发生转录和表观遗传变化,降低干扰素调节因子 Irf8 的启动子和基因体的 DNA 甲基化,启动髓细胞相关转录程序来招募肿瘤相关巨噬细胞(TAM),招募而来的浸润性巨噬细胞分泌 IFN-γ 进一步促进 Irf8 的表达,从而高效增强免疫逃逸。
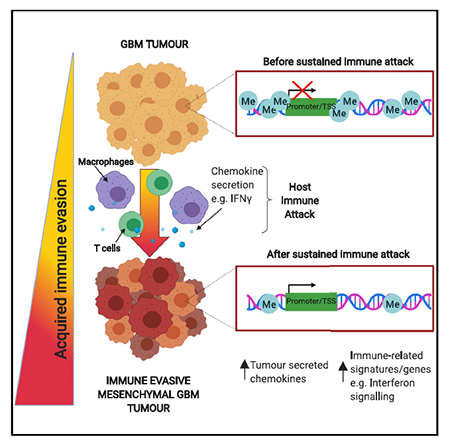
图片来源:Cell
研究内容
Part One:胶质母细胞瘤细胞模型与免疫活性肿瘤鼠模型的构建
作者分离了 BL6 小鼠的 NSCs(神经干细胞),通过分别突变五个被验证的致癌突变之一来构建 GSCs:过表达 EGFRvⅢ、PDGFRA,或 CRISPER 敲除 Nf1、Pten 或 Trp53。
由于单突变得到的 GSCs 仍表达神经干细胞标志物,作者又进行了联合突变,得到 NP(Nf1 和 Pten 突变)、NPE(NP 基础上过表达 EGFRvII),将 NP 移植到免疫损伤小鼠后只得到很小的原位瘤,而 NPE 的移植得到了高度侵袭性的肿瘤,且检测到 GBM 标志物。于是作者验证了 NPE 在免疫活性 BL6 宿主中的成瘤能力(图 1),成功得到用于探究 GBM 及其免疫微环境的免疫活性小鼠模型,同步将肿瘤植入免疫损伤 NSG 小鼠作为对照组。
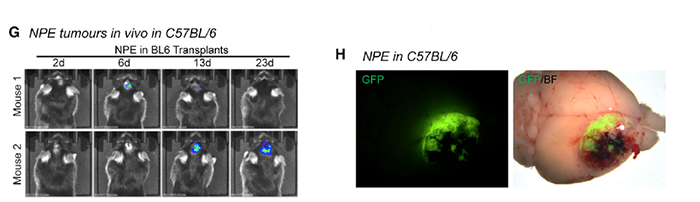
图片 1 来源:Cell
大多数 BL6 模型鼠都未出现明显的肿瘤(图 1G),且 BL6 模型鼠的生存期显著长于 NSG 组(图 2),这说明免疫微环境的确抑制了肿瘤形成。
Part Two:免疫逃逸肿瘤小鼠模型的构建
作者推测能在免疫活性小鼠中形成肿瘤的细胞或许是获得了免疫逃逸能力的
肿瘤细胞,于是连续从 BL6 模型鼠中提取 GSCs 进行多次移植:首先分离得到在体外表达 NSC 标志物的 NPE-BL6-TD(tumor derived)细胞,将其再次移植入新的 BL6 小鼠,分离得到成瘤性更强的 NPE-IE(immune evasion)植入新的 BL6 小鼠,最终得到生存期更短、成瘤性更强(图 2)的小鼠模型。但若以免疫受损小鼠为宿主,NPE 与 NPE-IE 细胞的成瘤能力相似(图 2),这进一步证实了 NPE-IE 细胞具有免疫逃逸能力。
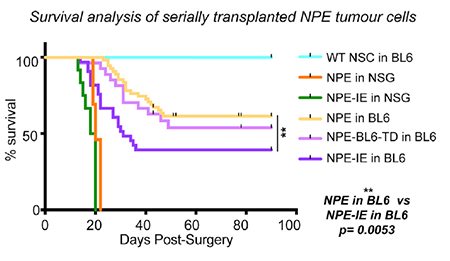
图片 2 来源:Cell
Part Three:免疫逃逸机制研究
作者比较了正常鼠脑与 NPE、NPE-IE 肿瘤鼠脑的免疫细胞群。结果显示,后者具有更多的 CD8/CD4 T 细胞和巨噬细胞(图 3)。
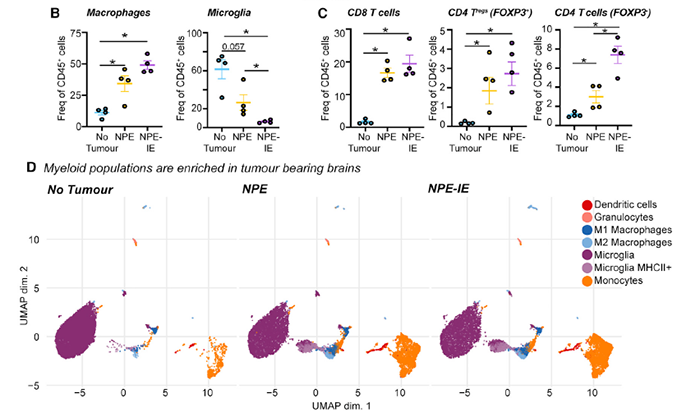
图片 3 来源:Cell
免疫组织化学染色显示,巨噬细胞主要集中在肿瘤组织而不是癌旁组织中(图 4)。
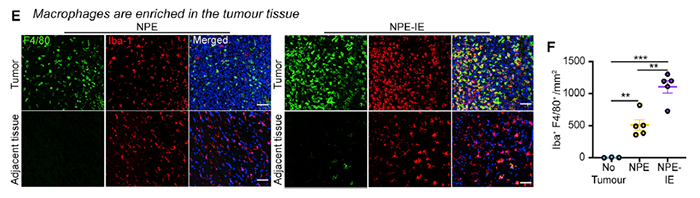
图片 4 来源:Cell
这说明具有免疫逃逸能力的 NPE-IE 肿瘤细胞招募了巨噬细胞。
有研究曾指出,CSF-1R (巨噬细胞克隆刺激因子 - 1 受体) 是一个潜在的胶质瘤高效治疗靶点 [2]。为了探究 NPE-IE 的免疫逃逸是否与巨噬细胞的招募有关,作者通过靶向 CSR-1R 的抑制性抗体清除 BL6 鼠的这些巨噬细胞,结果显示,NPE-IE 肿瘤显著减小甚至消失,小鼠生存期显著延长(图 5),且这一清除对免疫损伤小鼠没有明显影响。
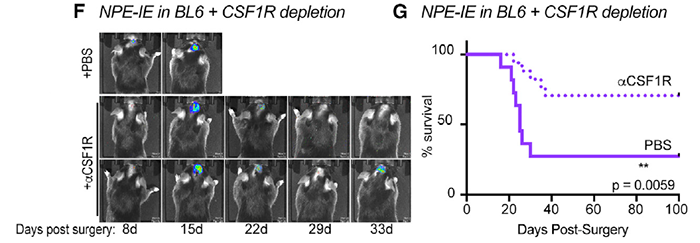
图片 5 来源:Cell
这说明巨噬细胞的招募在 BL6 小鼠 NPE-IE 肿瘤的免疫逃逸中发挥重要作用,于是作者进一步探究其招募机制。
基因组和转录组的分析显示 NPE-IE 与 NPE 细胞没有太大差异,于是作者又进行了 mRNA 测序,发现 NPE-IE 细胞的许多免疫相关基因存在显著不同的转录模式(图 6),尤其是之前被报道与肿瘤微环境相关的 Ccl9(巨噬细胞趋化因子 9)[3]。此外,Irf8(干扰素调节因子 8)在免疫活性小鼠中表达显著增加,这是一个令作者惊喜的现象,因为 Irf8 是髓细胞特异性的转录因子,它本应只在造血细胞中表达,曾有研究表明它与巨噬细胞的分化有关 [4]。这说明,受到免疫攻击后,NPE 细胞能够非正常地表达一种属于髓细胞的转录因子。
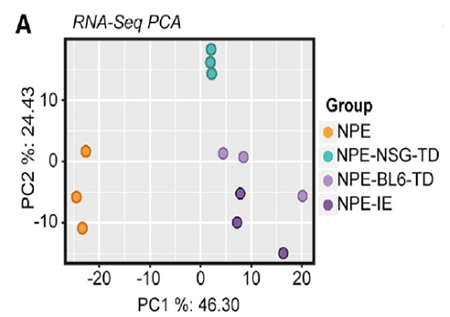
图片 6 来源:Cell
由于在小鼠模型中由免疫攻击引起的转录变化在体外培养后能够持续存在,作者猜测是发生了表观遗传变化,于是通过 RRBS 检测基因组甲基化水平。PCA 分析结果显示,相比于 NPE,NPE-IE 和 NPE-BL6-TD 的多个 DNA 甲基化显著降低(图 7),尤其是 Irf8 的启动子和基因体区域,去甲基化使其转录显著激活(图 8)。
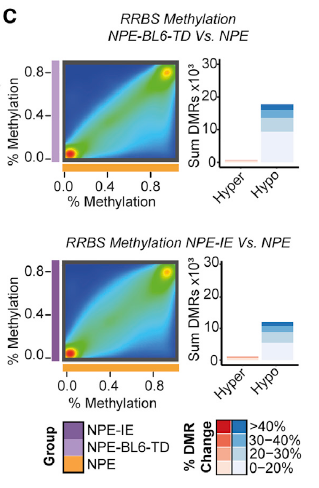
图片 7 来源:Cell
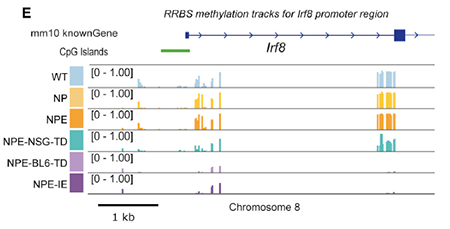
图片 8 来源:Cell
Irf8 是由巨噬细胞通过 IFN-γ 诱导 STAT1 信号通路促进分泌的,GO 分析显示 NPE-IE 细胞的确响应于 IFN-γ(图 9A),因此作者假设长期暴露于 IFN-γ 能够刺激 NPE 细胞激活 Irf8 的表达,并在体外验证了这一假设(图 9B-9C)。
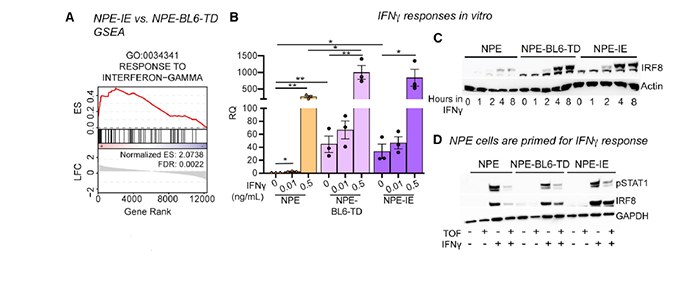
图片 9 来源:Cell
为了寻找驱动该转录变化的免疫细胞,作者从肿瘤组织中分离出免疫细胞与肿瘤细胞共培养,结果显示是巨噬细胞发挥这一作用(图 10G)。随后作者敲除 NPE-IE 的 Irf8,得到与 NPE 类似的侵袭性较小的肿瘤表型(图 10H),进一步证明了 IFN-γ 诱导的 Irf8 是诱导 NPE-IE 获得免疫逃逸能力的原因。
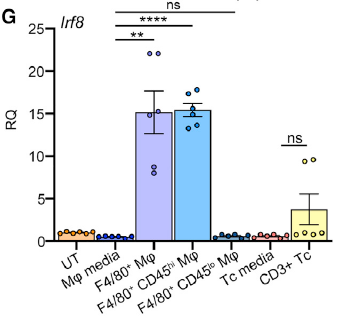
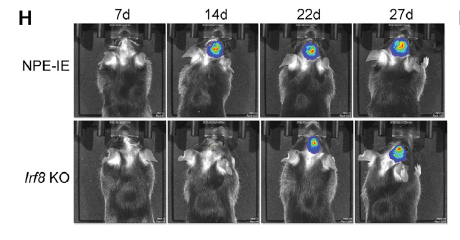
图片 10 来源:Cell
Part Four:临床验证
最后,作者回归临床,在人类胶质母细胞瘤中进一步验证了这一机制,证明了在人类胶质母细胞瘤中 IFN-γ 同样能够诱导免疫逃逸表型,且人类的具有免疫逃逸能力的胶质母细胞瘤 GBMs 与小鼠 NPE-IE 表现出相似的 DNA 甲基化(图 11)。
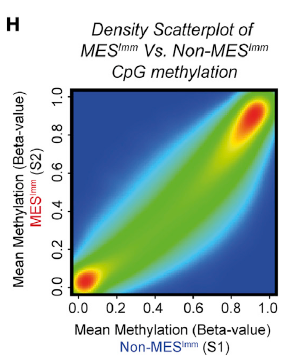
图片 11 来源:Cell
总之,本文阐述了胶质母细胞瘤的免疫逃逸与表观遗传变化之间的关系,揭示了免疫逃逸的重要调控机制,并证明了该机制在临床中的应用潜力。作者还指出,在 GBM 中发现的表观遗传免疫编辑过程或许在其他脑肿瘤或癌症中也发挥着重要作用,这无疑为抗肿瘤免疫的鸿图添上了极为关键的一笔。
论文链接:
[1]Aldape, K., Brindle, K.M., Chesler, L., Chopra, R., Gajjar, A., Gilbert, M.R., Gottardo,N., Gutmann, D.H., Hargrave, D., Holland, E.C., et al. (2019). Challengesto curing primary brain tumours. Nat. Rev. Clin. Oncol. 16, 509–520.
[2] Kortlever, R.M., Sodir, N.M., Wilson, C.H., Burkhart, D.L., Pellegrinet, L.,Brown Swigart, L., Littlewood, T.D., and Evan, G.I. (2017). Myc Cooperates with Ras by Programming Inflammation and Immune Suppression. Cell 171,1301–1315.e14.
[3] Pyonteck, S.M., Akkari, L., Schuhmacher, A.J., Bowman, R.L., Sevenich, L.,Quail, D.F., Olson, O.C., Quick, M.L., Huse, J.T., Teijeiro, V., et al. (2013).
[4] Tamura, T., Nagamura-Inoue, T., Shmeltzer, Z., Kuwata, T., and Ozato, K.(2000). ICSBP directs bipotential myeloid progenitor cells to differentiate intomature macrophages. Immunity 13, 155–165.













