
2021年4月,美国宾尼法尼亚大学学者Mark L. Kahn于Nature发表文章PIK3CA and CCM mutations fuel cavernomas through a cancer-like mechanism,其研究表明CCM的生长需要内皮细胞中的PI3K GOF和CCM LOF,并且CCM LOF和转录因子KLF4(一种下游MEKK3效应物)的增加表达增加了内皮细胞中的mTOR信号。与这些发现一致,mTORC1抑制剂雷帕霉素有效地阻断了小鼠模型中CCM的形成。
发生在中枢神经系统的血管畸形,如脑海绵状畸形,是年轻人中风和残疾的重要原因。经典的遗传研究支持了CCM疾病的单基因基础,该疾病与三个基因的双等位基因功能缺失(LOF)突变有关,这三个基因编码异源三聚体CCM蛋白复合物的成分。小鼠模型进一步揭示,新生小鼠脑内皮细胞中任何CCM基因的缺失都会导致CCM损伤,部分原因是MEKK3-KLF2/4信号增加。
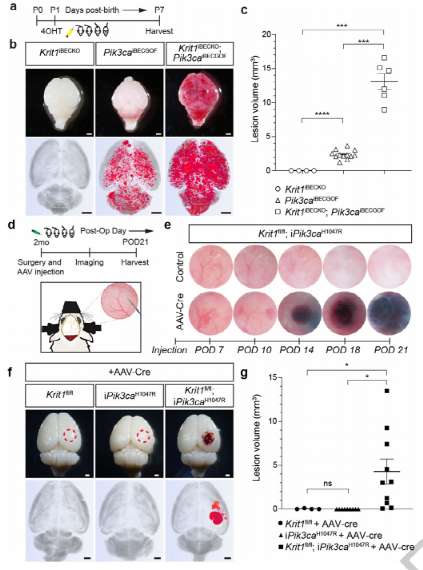
图1 :CCM LOF和PIK3CA GOF在新生儿脑海绵状血管畸形过程中协同作用,两者都是成人脑畸形所必需的。
人类连续扫描电镜成像显示,大多数细胞生长缓慢,临床上不活跃。相比之下,那些导致中风和癫痫发作的疾病通常增长迅速,并与反复的损伤性出血有关。如果可能的话,这种侵袭性的、有症状的病变可以通过手术切除,以预防或治疗相关的神经系统并发症,但是手术与高发病率和高成本相关,并且对于具有多个病变或病变位于手术难以到达的位置的患者是不切实际的。
为什么CCM病变的子集表现出与临床症状相关的快速增长尚不清楚。下面描述的研究表明,症状性CCM疾病是通过类似癌症的模式产生的,在这种模式中,同一细胞中多个体细胞突变的积累导致血管畸形抑制基因(即CCM基因)的缺失和血管畸形生长基因(即PIK3CA)的获得。
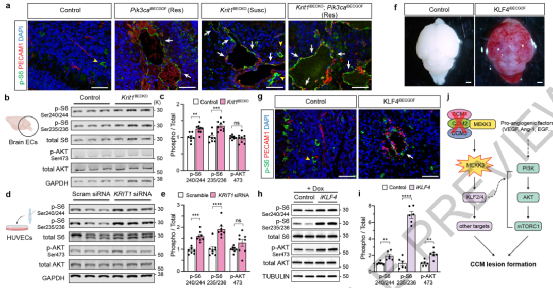
图3:内皮细胞CCM LOF通过KLF4增强PI3K-mTORC1信号。
这项研究最重要的概念性进展是发现了血管畸形发病的复合遗传机制。虽然血管畸形在起源上被认为是单基因的,但作者的研究确定了一种双基因的“三重打击”机制,包括获得多达三种不同的基因突变,最终导致CCM LOF和PIK3CA GOF,作为快速增长的临床症状性CCM的基础。与癌症类似,CCM基因可以被认为是血管“抑制基因”,需要抑制血管生长,而PIK3CA可以被认为是血管“癌基因”,能够驱动过度的血管生长。与癌症一样,血管抑制因子的丢失和血管激活因子的增加是一种强有力的组合,最终导致侵袭性的症状性疾病。作者的发现可以解释人类冠状动脉粥样硬化性心脏病发病机制的一个临床线索是,观察到散发性冠状动脉粥样硬化性心脏病经常发生在先前存在的发育性静脉异常(DVAs)的部位(24-32%通过磁共振成像评估,在一次外科评估中高达100%)。
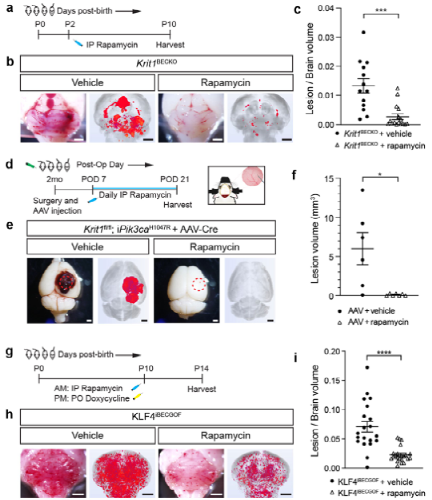
图4 :雷帕霉素可防止新生小鼠和成年小鼠因CCM LOF和KLF4 GOF而形成病变。
DVA在大多数考登综合征患者中发现,考登综合征是一种由PTEN生殖系杂合子LOF突变引起的遗传性疾病,可使PI3K功能增强。对这些观察的一个简洁的解释是,预先存在PIK3CA突变的内皮细胞足以使DVA随后获得CCM LOF突变,并转化为更具侵袭性的散发性CCM病变。虽然这种分子发病机制在DVA基因测序完成之前仍然是完全推测的,但它将支持一种高度类似于癌症的机制,在这种机制中,累积的突变将良性血管异常转化为更恶性的血管异常。
这项研究发现PIK3CA GOF在临床症状性、侵袭性CCM病变的生长中起因果作用,并且使用批准的药物抑制mTORC1可能减缓或阻止这种生长。尽管侵袭性颈动脉病变相对罕见,但它们几乎可以解释所有与该疾病相关的中风和神经症状,目前只能通过手术切除进行治疗。西罗莫司最近已被成功用于治疗与相同的PIK3CA GOF突变相关的淋巴和静脉/慢血流血管畸形,并且直接针对PIK3CA本身的新药物也被发现可有效治疗与PIK3CA GOF突变相关的不可手术的血管畸形。可以合理地预测,这种药物也将对治疗侵袭性CCM病变有效。
原文链接:
https://doi.org/10.1038/s41586-021-03562-8













