2021年4月14日,北京大学生命科学学院蒋争凡实验室在Immunity上以Research Article形式在线发表了STING需要进行高尔基体转运的机制研究“Golgi-synthesized sulfated glycosaminoglycans mediate polymerization and activation of the cGAMP sensor STING”,揭示了粘多糖(硫酸化糖胺聚糖)是STING共配体及STING转位至高尔基体活化的原因。

在本研究中,来自蒋争凡实验室的方润博士和蒋启飞同学巧妙地利用了STING自激活突变体诱导细胞死亡的特性,在二倍体细胞HT1080中进行了基于CRISPR–Cas9介导的全基因组筛选,发现多个参与硫酸化糖胺聚糖(粘多糖)合成的关键基因被高度富集(图1)。这些粘多糖合成关键基因的敲除使细胞丧失了对STING的反应性。
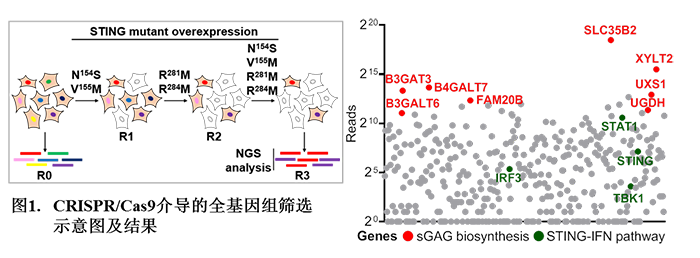
随后,他们通过在不同细胞中构建基因敲除细胞株,进一步证明在高尔基体内发生的粘多糖合成缺失会严重削弱cGAS-STING通路的激活。为了研究硫酸化糖胺聚糖是否直接作用于STING,他们选用了荷载硫酸化糖胺聚糖的核心蛋白SRGN作为硫酸化糖胺聚糖的指针,发现STING和SRGN存在DNA病毒诱导的共定位和相互作用(图2A)。用携带肝素的磁珠进行体外pull-down实验也表明STING和肝素存在直接的相互作用,且结合cGAMP的STING具有更强的肝素结合能力(图2B)。硫酸化糖胺聚糖由于荷载大量带负电的硫酸化修饰,因而主要通过静电相互作用与靶蛋白上的正电氨基酸残基结合来发挥功能。由于胞内硫酸化糖胺聚糖被包裹在高尔基体腔内,他们推测位于STING第一和第二跨膜区之间的三个正电氨基酸残基(H42,R45,H50)可能参与结合硫酸化糖胺聚糖(图2C)。将这三个正电氨基酸进行突变会显著削弱STING的激活(图2D)。进一步将位于STING第一和第二跨膜区及第三和第四跨膜区内的极性氨基酸进行突变则会使STING的活性逐步降低直至完全消失。有意思的是,回复H42,R45,H50三个正电氨基酸中的任意一个都可使完全没有活性的突变体恢复部分的活性。将42位或50位回复为电性更强的赖氨酸或精氨酸,STING的活性会随着回复的氨基酸的正电荷增多而逐渐增强。有意思的是,在不含有正电氨基酸的第三和第四跨膜区引入正电氨基酸(P110R)也会部分回复突变STING的活性。免疫共沉淀实验发现各种STING突变体与SRGN的相互作用强度和这些突变体的活性有非常一致的相关性;更重要的是,通过引入额外的带正电的精氨酸(Y46R/H50R,H50R/P110R等)则会使STING组成性地结合硫酸化糖胺聚糖而发生自激活(图2E)。这些结果表明硫酸化糖胺聚糖的结合能力是决定STING能否激活及激活强度的决定因素之一。
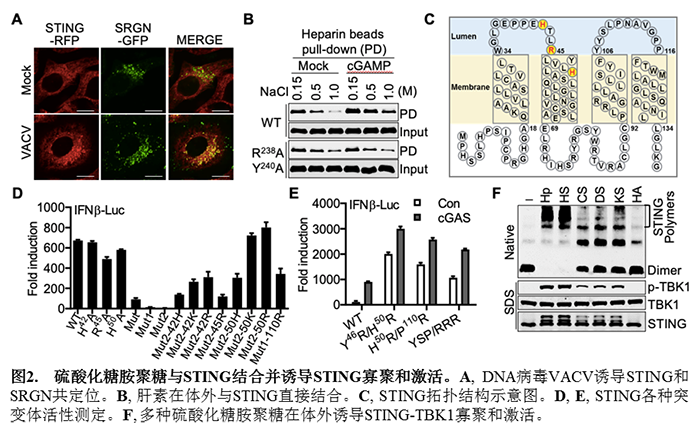
为了进一步研究硫酸化糖胺聚糖如何介导STING的激活,他们通过体外实验发现多种硫酸化糖胺聚糖和纯化的全长STING蛋白及TBK1蛋白共孵育时都能不同程度的诱导STING多聚体的形成及TBK1的磷酸化,其中硫酸肝素(HS)和肝素(Hp)的激活效果最佳(图2E)。进一步实验发现硫酸化糖胺聚糖激活STING是糖链长度依赖的,最短由四个单糖形成的糖链即具有激活STING的能力,并且这种激活依赖于糖链上的O-位硫酸化修饰。更为重要的是,通过对人、小鼠、蝙蝠和鸡四种来源的STING进行分析发现,硫酸化糖胺聚糖介导STING激活的机制在进化上是高度保守的。最后,他们通过小鼠实验表明硫酸化糖胺聚糖的合成对于小鼠抵抗DNA病毒VACV的感染十分关键。
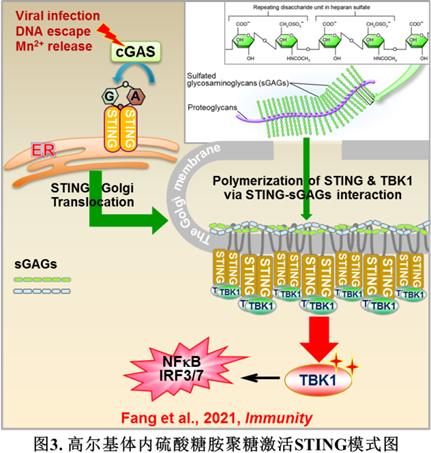
综上所述,该研究发现高尔基内合成的硫酸化糖胺聚糖对STING-TBK1活化至关重要并且非常保守:高尔基体内的sGAGs与发生转位的STING直接结合,像铰链一样引发STING的多聚化,进而招募并促进TBK1的自磷酸化及下游通路活化(图3)。该发现揭开了STING为何需要离开内网转位至高尔基体才能激活这一困扰多年的谜题,有望打通STING活化的“最后一公里”。此外,该研究填补了硫酸化糖胺聚糖的胞内生理学功能研究的空白,揭示了生物多糖在细胞内的关键免疫学功能,为未来生物多糖在抗病毒、抗肿瘤的临床实践提供新的线索。
北京大学生科院博士后方润和2015级博士生蒋启飞为该文章的共同第一作者,生科院/北大—清华生命科学联合中心的蒋争凡教授为通讯作者。













