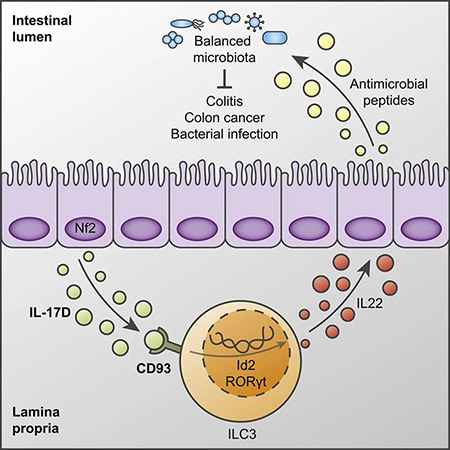
2021年4月13日,清华大学免疫学研究所董晨院士团队在免疫学顶级期刊 Immunity 在线发表了题为:Interleukin-17D regulates group 3 innate lymphoid cell function through its receptor CD93 的研究论文。该研究首次鉴定了IL-17D的功能性受体为CD93,并揭示IL-17D通过结合CD93调节ILC3细胞的功能并参与维持肠道稳态。在该研究中,研究人员在DSS诱导的小鼠结肠炎模型中发现,与野生型小鼠相比,IL-17D基因缺陷型小鼠结肠炎显著加重,表现为体重减轻、结肠缩短、上皮细胞损伤加剧、炎症相关细胞因子表达显著增加。除了DSS诱导的结肠炎模型,研究人员发现IL-17D缺失也导致小鼠对AOM-DSS诱导的结肠癌以及C. rodentium感染疾病的易感。这些表型说明IL-17D在肠道疾病中起着保护作用。此外,研究人员发现该保护作用主要是通过上皮细胞分泌的IL-17D参与实现的。机制上,研究人员发现IL-17D主要通过天然淋巴细胞ILC3发挥作用。不管是稳态下还是炎症环境下,在IL-17D缺陷的小鼠中,ILC3分泌IL-22的能力以及IL-22依赖的下游抗菌蛋白(RegIIIβ、RegIIIγ)的表达均受到抑制,进而引起了IL-17D缺陷小鼠肠道菌群失调。进一步的研究发现:IL-17D缺陷小鼠中,补充IL-22蛋白减缓了结肠炎疾病的进展;补充IL-17D蛋白一方面能够减轻结肠炎的发病程度,另一方面能够恢复Il22、 Reg3b、Reg3g的表达水平。这些发现表明IL-17D通过调控ILC3细胞的功能发挥其生物学作用。研究团队接着首次鉴定了IL-17D的受体。为此,研究人员首先利用293T过表达系统从IL-17受体家族中(IL-17RA到IL-17RE)筛选IL-17D的潜在受体,结果发现:IL-17D并不与该家族中的任何成员结合,包括同二聚体或者异二聚体的形式。通过与多种细胞系的结合实验发现IL-17D能够结合于RAW264.7细胞,提示该细胞上可能有IL-17D的受体存在。排除了与经典的IL-17受体相结合的可能性后,研究人员通过免疫沉淀-质谱鉴定(IP-MS)技术以RAW264.7为工具细胞开展对IL-17D受体的鉴定工作。从质谱结果的两百多个蛋白中,研究者就其中21个膜蛋白进行了293T过表达以及IL-17D蛋白的结合实验,结果发现:只有过表达CD93的293T细胞能与IL-17D结合;此外,通过表面等离子体共振实验证实CD93是IL-17D的受体,其亲和力接近于同家族的IL-17F与受体IL-17RA的结合。此外,通过染色以及对数据库中单细胞RNA-seq分析,研究人员发现CD93主要表达于ILC3细胞,尤其是效应ILC3细胞。转录组学的数据显示与CD93阴性ILC3细胞相比,CD93阳性ILC3细胞高表达ILC3效应分子,如Il23r、Il1r、Rorc、Rora、Id2、Il22、Il17a、Csf2等参与细胞-细胞因子受体相互作用以及防御反应的基因。利用CRISPR-Cas9技术构建Cd93基因敲除小鼠,研究者发现IL-17D与肠道ILC3细胞的结合依赖于CD93的表达,CD93缺失也导致小鼠对结肠炎以及结肠癌的诱导产生敏感。为了进一步探究IL-17D-CD93 信号对ILC3细胞的调控作用,研究者还构建了ILC3细胞特异性CD93基因敲除小鼠(RorccreCD93fl/fl)。与IL-17D缺陷的表型一致, RorccreCD93fl/fl小鼠中ILC3细胞分泌IL-22的能力受到严重影响,且ILC3细胞上CD93的缺失加剧了小鼠结肠炎的疾病症状。这项研究从生化层面、细胞水平和生理功能三个方面揭示了CD93是IL-17D的受体;同时,对于理解IL-17D在免疫系统及相关疾病中的作用和机制具有重要意义。这项工作是董晨院士团队长期、系统研究IL-17及其受体家族的又一里程碑式的成果,对于理解这个细胞因子家族和粘膜免疫有重要意义,也提示了治疗炎症疾病的新靶点。清华大学医学院博士后黄金伶为该论文的第一作者,清华大学免疫所教授、上海交通大学医学院附属仁济医院研究员董晨院士为本文的通讯作者。本研究由科技部重点研发项目、国家自然科学基金委、北京市科委等多个项目提供支持。https://www.cell.com/immunity/fulltext/S1074-7613(21)00130-8