北京时间 2021 年 4 月 8 日晚 23 时,北京大学生命科学学院蒋争凡实验室在 Nature Cell Biology 上以 Research Article 形式在线发表了他们在天然免疫及蛋白质相分离领域的最新成果 —The STING Phase-Separator Suppresses Innate Immune Signaling。
北京大学生科院 2016 级博士生于晓彧同学为论文的第一作者,生科院 / 北大 -- 清华生命科学联合中心的蒋争凡教授为通讯作者。生科院 2019 级博士生张沥元同学帮助了本项研究。

细胞内除生物膜包被的各种细胞器外,还有许多无膜包被的独立空间,如由大量蛋白和 RNA 组成的核仁及核周无膜区域(RNA 处理小体,即 P-body)、DNA 损伤修复区域 PML body、应激颗粒(Stress granules)等。这类独立空间现在被统称为生物分子凝集体,能为一系列生化反应提供特定的空间或场所。大量的研究表明这凝集体通常富集了含有多个介导分子内部或分子间相互作用元素的多价分子,它们会自发聚集,形成寡聚物或聚合物,而由于熵驱动效应,这种自发聚集将降低分子的溶解度,从而促进相分离发生,富集特定分子(1,2)。
多价分子主要包括含有模块化结构域或内在无序结构域(IDR)的蛋白,提供分子内与分子间的弱相互作用,介导凝集体形成(3,4)。凝集体通常会经历「成熟或固化」过程,由液态转变为胶体或固体(5-8)。凝集体拥有独特的物理与生化性质,能在生化反应速率、反应特异性、物质运输、膜泡融合及细胞器物质贮藏等方面发挥重要的生物学功能(9)。
膜包被细胞器与无膜包被的生物分子凝集体在许多生物过程中有相互作用。膜可以作为装配平台或直接接触来调节凝集体的发生和动力学。膜相关蛋白质的相分离参与了各种物质转运;相分离还可对跨膜运输的物质进行分拣和对接并促进物质转运。但是,目前蛋白质相分离的研究都是可溶性蛋白,或者是与膜蛋白结合的可溶性蛋白,而跨膜蛋白自身由于相分离形成细胞内特殊膜结构未曾有报道。
立方膜结构(Cubic membranes,又称作 Karmellae、Whorls、Organized smooth ER、Tubuloreticular structures 或 Cylindrical Confronting Cisternae, CCC),是 1959 年哥伦比亚大学的 Pappas 和 Brandt 在卡罗林多核变形虫细胞的线粒体中最先观察到的一类由线粒体膜堆叠形成的高度组织化的三维周期性膜结构(10)。因为与立方相有高度相似性,称之为立方膜结构。
此后的数百篇研究论文发现这类立方膜结构几乎存在于自然界所有生命体的各种细胞中。它们并不严格与任何特定的细胞器相关,可以从几乎任何一种细胞膜变化而来:质膜、内质网、核膜(内部和外部)、线粒体内膜、叶绿体以及高尔基体。如非洲爪蛙睾丸支持细胞或鼩鼱视网膜锥细胞的线粒体内膜产生不同类型的立方膜结构,最多可由 12 层膜折叠形成;植物韧皮部参与长距离物质运输的细胞存在两个结构相同但晶格不同的立方膜结构;细菌存在多层似晶格的光合膜结构;蓝藻光合类囊体膜连续折叠形成「螺旋状晶格」膜结构。
动物细胞中,立方膜结构经常出现在病理条件下(感染、肿瘤、很多种自身免疫病)(11),与细胞应激如蛋白质合成异常、活性氧 ROS 产生密切相关。如快速复制的肿瘤细胞核膜内膜发现立方膜结构。更重要的是,各种各样的病原微生物感染会诱导不同细胞器膜产生立方膜结构。如内质网膜形成的立方膜结构长期被作为 HBV(12)或 SIV/HIV(13-15)病毒感染的病理学标志物,而这些病毒都激活 cGAS-STING 通路(16,17)。
令人惊奇的是,大量临床研究论文报道在绝大多数艾滋病患者的淋巴细胞内存在内质网立方膜。RNA 病毒感染则常常导致线粒体膜 (12) 或者质膜(18)产生立方膜结构,或者通过产生 ROS 诱导形成内质网立方膜,如 SARS 病毒(19)。遗憾的是,直到现在,人们对这些结构产生的原因和功能几乎一无所知。一个与此相关的有趣现象是:由于该类结构被不同的研究者在不同细胞的不同细胞器膜发现,形成原因和功能又都未知,因此有超过 130 种不同的、五花八门的命名(20,21)。
cGAS 是胞质内的双链 DNA(dsDNA)受体,也是一个二核苷酸环化酶。被 DNA 激活的 cGAS 合成第二信使 2'3'-cGAMP,后者进一步激活 STING(MITA/ERIS),最终诱导 I - 型干扰素等细胞因子产生;而细胞应激后从不同细胞器释放的 Mn2 + 则是第二种 cGAS 激活剂,在生理条件下可不依赖于 DNA,直接结合并激活 cGAS,并以一种效率更高的路径合成 2'3'-cGAMP(22-24)。STING 是分布于内质网的 4 次跨膜蛋白,与 2'3'-cGAMP 结合后需要发生转运,离开内质网经高尔基体,最后到高尔基体来源的小膜泡上(称之为 STING translocators);而 STING 的活化为什么必须要发生这种高尔基体的转运一直很不清楚。
最近北京大学蒋争凡实验室通过基于 STING 过度活化导致细胞死亡而进行的全基因组 CRISPR/Cas9 筛选,发现 STING 的活化需要两种配体:1)细胞质里的环化二核苷酸(如 2'3'-cGAMP);2)高尔基体内的硫酸化糖胺聚糖(sGAGs)。前者诱导 STING 转移到高尔基体,后者导致 STING 多聚化,招募并激活 TBK1。sGAGs 与 STING 结合后,像铰链一样引发 STING 发生多聚化,进而招募并促进 TBK1 的自磷酸化及下游通路活化(Fang et al., 2021, Immunity)。
重要的是,cGAS 也会被泄露到细胞质的自身 DNA 或者细胞内累积的 Mn2 + 激活,在抗肿瘤免疫,自身免疫病,细胞损伤及衰老等过程中发挥重要作用(25-27)。Mn2 + 和 PD-1 抗体联合使用的「锰免疗法」可显著增强 PD-1 抗体的肿瘤治疗效果 27。类似 Mn2 + 通过激活 cGAS-STING 通路促进肿瘤治疗的方法也被国内外多个实验室所发现或证实(28-30)。
目前,蛋白质相分离参与天然免疫调节的研究刚刚开始,仅有的两个报道是发现了 cGAS 与 DNA 结合后发生二聚化 / 寡聚化并导致 cGAS 蛋白的相分离(31,32),其中锌离子(Zn2+)是一个重要的促进因子。
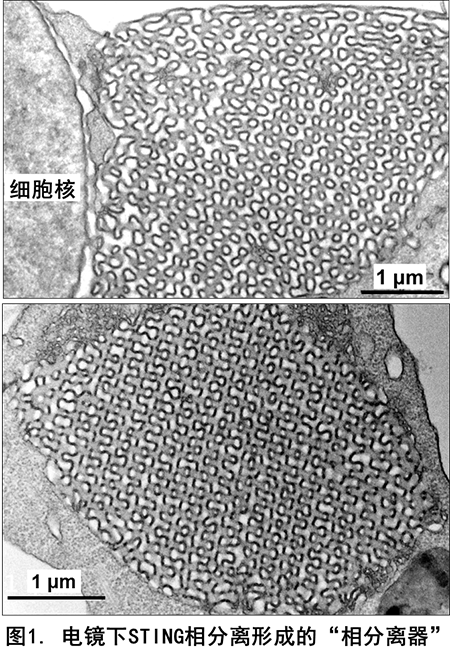
本研究工作中,蒋争凡实验室的于晓彧同学首先发现在 DNA 病毒感染后期的细胞内,或体外用 STING 激活剂(2'3'-cGAMP、c-di-GMP)处理的细胞内,均可观察到未进行高尔基体转运的 STING 蛋白在内质网膜形成不少有高度液滴性质的微米级别的凝集体。荧光漂白技术发现细胞内 STING 形成的凝集体非常类似于可溶性蛋白发生液相 - 液相分离形成的相分离液滴。
更令人惊奇的是,光镜 - 电镜联合技术并结合免疫电镜显示 STING 蛋白形成的凝集体是一个由内质网膜形成的、高度特化的内部像拼图样(Puzzle-like)的膜结构(图 1);三维重组后的结果则显示在细胞核周围形成「蜂窝状」的「类细胞器」样结构,非常类似于艾滋病患者淋巴细胞中广泛存在的内质网「立方膜结构」。STING-APEX 标记、染色的电镜下呈现的 STING 相分离膜结构中充满了密布 STING 的、由内质网囊泡堆叠、挤压形成的「单位膜」;而电镜下 STING translocators 则显著不同,APEX 染色显示为直径 100 nm 左右的小膜泡,STING 非常密集地分布于膜泡外围。
他们进一步通过在 293FT 细胞中纯化人源 STING 全长蛋白,成功在体外重建了 STING 纯化蛋白的相分离,体外诱导形成的 STING 相分离液滴也具有类似于细胞内的内在结构,而非均质(图 2)。利用体外重建的相分离体系,他们发现超过一定浓度(阈值)的 2'3'-cGAMP 可以强烈诱导 STING 蛋白发生相分离;而 Mn2 + 可显著降低所需的 2'3'-cGAMP 浓度,Mg2 + 或 Zn2 + 则无此作用。细胞质中,病毒感染后活化的 cGAS 持续性地产生并且累积 2'3'-cGAMP,而目前尚没有发现细胞质内特异性降解 2'3'-cGAMP 的磷酸酯酶。
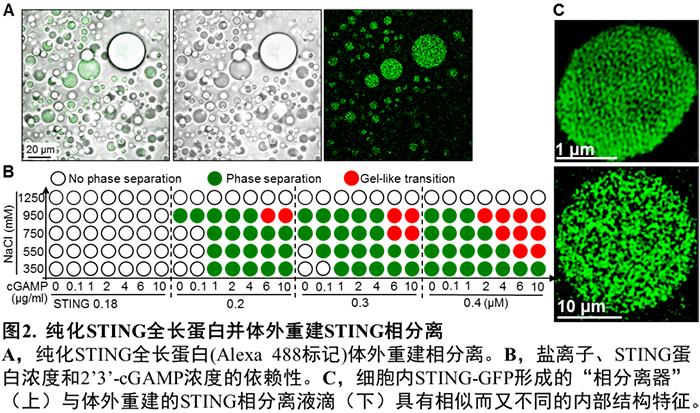
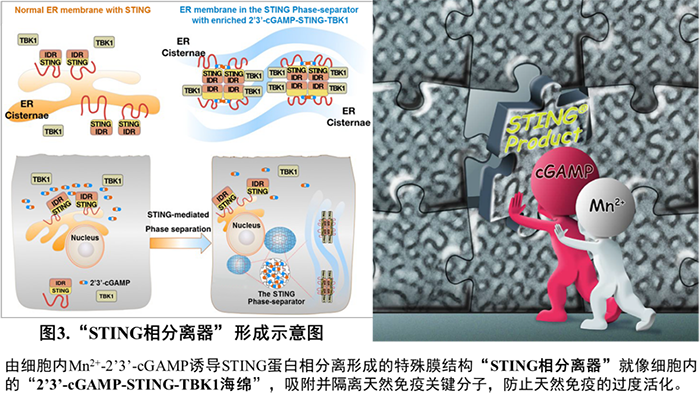
这些结果提示:细胞内适度水平的 2'3'-cGAMP 会诱导 STING 转运至高尔基体并发生抗病毒天然免疫通路的活化;而在病毒感染后期,细胞内过度累积的 2'3'-cGAMP 则能够诱导留存在内质网、没有被活化的 STING 蛋白发生相分离。STING309-342 片段被确定为介导相分离的 IDR 区域;该结构域中两个保守氨基酸突变体 E336G/E337G 丧失相分离的能力。后续的实验结果进一步提示 STING 相分离产生的内质网立方膜结构可能通过在空间上将 STING-TBK1 与关键转录因子 IRF3 进行「隔离」,进而负调节 cGAS-STING 通路。
因此,这个由细胞内高浓度 2'3'-cGAMP 触发、Mn2 + 促进、STING 蛋白相分离形成的内质网立方膜结构被命名为「STING 相分离器」(STING Phase-Separator),用于对未激活的 STING-TBK1(也包括 2'3'-cGAMP)进行分隔,从而在一个新的层次防止天然免疫的过度活化(图 3)。实际上,该立方膜就像一个「 2'3'-cGAMP-STING-TBK1 海绵」,吸附并抑制天然免疫关键分子,最终这些立方膜结构会被溶酶体或自噬体分解。这样的调节机制还暗示细胞并不需要胞内的 2'3'-cGAMP 特异性降解酶。
与上述结果相吻合的是,细胞内表达大多数 STING 相关自身免疫病(STING-associated autoimmune disease)的 STING 突变体形成 STING 相分离器的能力均受到显著抑制,暗示 STING 相分离器的下调产生可能在病理条件下的异常作用。STING Phase-Separator 形成的具体分子机制,包括如何形成这样特异的膜结构及其可能的生理学功能还有待进一步的研究。
综上所述,该工作提示 60 余年前发现的存在于几乎所有生命体各种细胞内的各类立方膜结构的形成可能受相关跨膜蛋白相分离的驱动;而由膜蛋白相分离形成的这类膜结构是细胞正常生命活动的一部分,并在多种生理、病理过程中扮演重要角色。因此,通过蛋白相分离的角度研究这些细胞内独特膜结构的形成与生理学功能,尤其是病理学功能可能具有重要的理论及实际意义。
本研究工作得到了国家自然科学基金委、科技部国家重点基础研究项目、北京大学「细胞增殖与分化」教育部重点实验室及「北大 -- 清华生命科学联合中心」的资助。
相关论文信息:
https://dx.doi.org/10.1038/s41556-021-00659-0
1, Banani, S. F., Lee, H. O., Hyman, A. A. & Rosen, M. K. Biomolecular condensates: organizers of cellular biochemistry. Nat Rev Mol Cell Biol 18, 285-298, doi:10.1038/nrm.2017.7 (2017).2, Boeynaems, S. et al. Protein Phase Separation: A New Phase in Cell Biology. Trends Cell Biol 28, 420-435, doi:10.1016/j.tcb.2018.02.004 (2018).3, Nott, T. J. et al. Phase transition of a disordered nuage protein generates environmentally responsive membraneless organelles. Mol Cell 57, 936-947, doi:10.1016/j.molcel.2015.01.013 (2015).4, Zeng, M. et al. Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175 e1112, doi:10.1016/j.cell.2016.07.008 (2016).5, Shin, Y. & Brangwynne, C. P. Liquid phase condensation in cell physiology and disease. Science 357, doi:ARTN eaaf438210.1126/science.aaf4382 (2017).6, Brangwynne, C. P. et al. Germline P Granules Are Liquid Droplets That Localize by Controlled Dissolution/Condensation. Science 324, 1729-1732, doi:10.1126/science.1172046 (2009).7, Patel, A. et al. A Liquid-to-Solid Phase Transition of the ALS Protein FUS Accelerated by Disease Mutation. Cell 162, 1066-1077, doi:10.1016/j.cell.2015.07.047 (2015).8, Li, P. et al. Phase transitions in the assembly of multivalent signalling proteins. Nature 483, 336-340, doi:10.1038/nature10879 (2012).9, Wang, Z. & Zhang, H. Phase Separation, Transition, and Autophagic Degradation of Proteins in Development and Pathogenesis. Trends Cell Biol 29, 417-427, doi:10.1016/j.tcb.2019.01.008 (2019).10, Pappas, G. D. & Brandt, P. W. Mitochondria. I. Fine structure of the complex patterns in the mitochondria of Pelomyxa carolinensis Wilson (Chaos chaos L.). J Biophys Biochem Cytol 6, 85-90, doi:10.1083/jcb.6.1.85 (1959).11, Snapp, E. L. et al. Formation of stacked ER cisternae by low affinity protein interactions. J Cell Biol 163, 257-269, doi:10.1083/jcb.200306020 (2003).12, Schaffner, F., Dienstag, J. L., Purcell, R. H. & Popper, H. Chimpanzee livers after infection with human hepatitis viruses A and B: Ultrastructural studies. Arch Pathol Lab Med 101, 113-117 (1977).13, Kostianovsky, M., Orenstein, J. M., Schaff, Z. & Grimley, P. M. Cytomembranous inclusions observed in acquired immunodeficiency syndrome. Clinical and experimental review. Arch Pathol Lab Med 111, 218-223 (1987).14, Lee, S., Harris, C., Hirschfeld, A. & Dickson, D. W. Cytomembranous inclusions in the brain of a patient with the acquired immunodeficiency syndrome. Acta Neuropathol 76, 101-106, doi:10.1007 /bf00687686 (1988).15, Kaup, F. J., Bruno, S. F., Matz-Rensing, K. & Schneider, T. Tubuloreticular structures in rectal biopsies of SIV-infected rhesus monkeys (Macaca mulatta). Ultrastruct Pathol 29, 357-366, doi:10.1080/019131290968740 (2005).16, Sun, L. et al. Coronavirus papain-like proteases negatively regulate antiviral innate immune response through disruption of STING-mediated signaling. PLoS One 7, e30802, doi:10.1371/journal.pone. 0030802 (2012).17, Gao, D. et al. Cyclic GMP-AMP synthase is an innate immune sensor of HIV and other retroviruses. Science 341, 903-906, doi:10.1126/science.1240933 (2013).18, Schaff, Z., Eder, G., Eder, C. & Lapis, K. Ultrastructure of normal and hepatitis virus infected human and chimpanzee liver: similarities and differences. Acta Morphol Hung 40, 203-214 (1992).19, Almsherqi, Z. A., McLachlan, C. S., Mossop, P., Knoops, K. & Deng, Y. Direct template matching reveals a host subcellular membrane gyroid cubic structure that is associated with SARS virus. Redox Rep 10, 167-171, doi:10.1179/135100005X57373 (2005).20, Chong, K. & Deng, Y. The three dimensionality of cell membranes: lamellar to cubic membrane transition as investigated by electron microscopy. Methods Cell Biol 108, 319-343, doi:10.1016 /B978-0-12-386487-1.00015-8 (2012).21, Almsherqi, Z. A., Landh, T., Kohlwein, S. D. & Deng, Y. Chapter 6: cubic membranes the missing dimension of cell membrane organization. Int Rev Cell Mol Biol 274, 275-342, doi:10.1016 /S1937-6448(08)02006-6 (2009).22, Zhao, Z. et al. Mn(2+) Directly Activates cGAS and Structural Analysis Suggests Mn(2+) Induces a Noncanonical Catalytic Synthesis of 2'3'-cGAMP. Cell Rep 32, 108053, doi:10.1016/j.celrep.2020. 108053 (2020).23, Hooy, R. M., Massaccesi, G., Rousseau, K. E., Chattergoon, M. A. & Sohn, J. Allosteric coupling between Mn2+ and dsDNA controls the catalytic efficiency and fidelity of cGAS. Nucleic Acids Res 48, 4435-4447, doi:10.1093/nar/gkaa084 (2020).24, Wang, C. et al. Manganese Increases the Sensitivity of the cGAS-STING Pathway for Double-Stranded DNA and Is Required for the Host Defense against DNA Viruses. Immunity 48, 675-687 e677, doi:10.1016/j.immuni.2018.03.017 (2018).25, Chen, Q., Sun, L. & Chen, Z. J. Regulation and function of the cGAS-STING pathway of cytosolic DNA sensing. Nat Immunol 17, 1142-1149, doi:10.1038/ni.3558 (2016).26, Xu, M. M. et al. Dendritic Cells but Not Macrophages Sense Tumor Mitochondrial DNA for Cross-priming through Signal Regulatory Protein alpha Signaling. Immunity 47, 363-373 e365, doi:10.1016/j.immuni.2017.07.016 (2017).27, Lv, M. et al. Manganese is critical for antitumor immune responses via cGAS-STING and improves the efficacy of clinical immunotherapy. Cell Res 30, 966–979, doi:10.1038/s41422-020-00395-4 (2020).28, Song, Y. et al. Manganese enhances the antitumor function of CD8(+) T cells by inducing type I interferon production. Cell Mol Immunol, doi:10.1038/s41423-020-00524-4 (2020).29, Hou, L. et al. Manganese-Based Nanoactivator Optimizes Cancer Immunotherapy via Enhancing Innate Immunity. ACS Nano 14, 3927-3940, doi:10.1021/acsnano.9b06111 (2020).30, Wang, C. et al. Maintaining manganese in tumor to activate cGAS-STING pathway evokes a robust abscopal anti-tumor effect. J Control Release 331, 480-490, doi:10.1016/j.jconrel.2021.01.036 (2021).31, Du, M. & Chen, Z. J. DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361, 704-709, doi:10.1126/science.aat1022 (2018).32, Zhou, W., Mohr, L., Maciejowski, J. & Kranzusch, P. J. cGAS phase separation inhibits TREX1-mediated DNA degradation and enhances cytosolic DNA sensing. Mol Cell 81, 739-755 e737, doi:10.1016/j.molcel.2021.01.024 (2021).

















