2021年3月18日,肿瘤学顶尖杂志Cancer Cell在线发表了来自美国加州大学圣迭戈分校(UCSD)与南京大学医学院附属鼓楼医院合作的一项研究成果,由Michael. Karin教授和孙倍成教授共同领衔的研究团队(苏华博士为论文第一作者),揭示了通过细胞自噬(autophagy)和巨胞饮途径(macropinocytosis, MP)抑制肿瘤生长的新机制。

自噬是细胞内重要的物质分解代谢过程,阐明自噬作用的研究曾在2016年获得了诺贝尔生理学或医学奖。一般认为,肿瘤细胞自噬活性旺盛。以最为凶险的癌症之一胰腺导管腺癌(pancreatic adenocarcinoma, PDAC)为例,PDAC细胞被发现自噬活性极高,是其维持高代谢状态的关键因素之一。
▲细胞自噬通过降解细胞内受损蛋白质活细胞器,维持细胞稳态(图片来源:123RF)
基于这些发现,抑制自噬作用的药物被很多人寄予厚望,希望产生抗癌疗效。然而,研究作者在论文中指出,一系列相关临床试验中,单一使用自噬抑制剂并没能显著改善患者生存率,这提示肿瘤细胞中存在其他能量获取机制。因此,如何更有效地抑制肿瘤细胞代谢,引起了这支研究团队的兴趣。
他们首先在小鼠模型中分析了患者来源的异体移植瘤(patient derived xenograft),发现IKKα低表达与自噬抑制正相关。对不同人胰腺癌细胞的分析也得到了类似结果。
进一步分析大量人胰腺癌细胞的基因表达谱发现,IKKα低表达的肿瘤细胞在逃逸自噬抑制时,一系列巨胞饮途径相关基因和生长因子基因的表达呈负相关。巨胞饮是指细胞通过形成巨胞饮小体(macropinosome)摄取细胞外可溶性成分至溶酶体降解获取营养,是一种进化上保守的肌动蛋白依赖性内吞途径。体内和体外实验研究证明,抑制自噬会促进肿瘤细胞的巨胞饮活性,使它们从细胞外提取养分、用于产生能量。
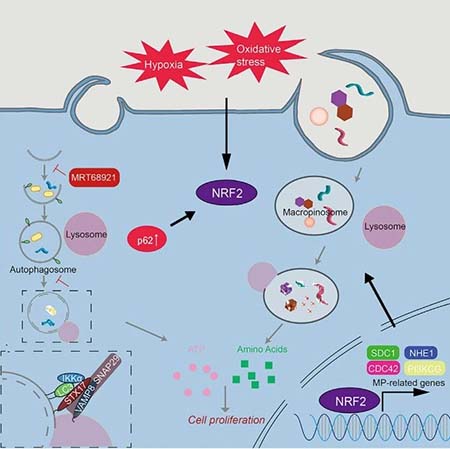
▲研究机制示意图(图片来源:参考资料[1])
机制研究和对大量胰腺癌临床样本的分析还显示,NRF2是调控巨胞饮途径中相关基因的关键分子。除自噬抑制外,氧化应激、低氧或炎症因子TNFα诱导的巨胞饮同样依赖于NRF2。
“这些结果首次阐述了经典细胞自噬与巨胞饮的关系,并揭示了巨胞饮途径的转录调控机制,为研究肿瘤代谢调控提供了新思路。”苏华博士说。
在发现了抑制自噬会上调巨胞饮的新机制后,研究团队进一步探索了抑制肿瘤生长的新型治疗策略。在多个肿瘤模型中,研究人员单独或联合使用特异性抑制细胞自噬和巨胞饮的抑制剂,发现联合用药可以显著抑制肿瘤生长。
综上,该研究发现,肿瘤细胞通过NRF2激活的巨胞饮途径获取营养物质逃逸自噬抑制,联合抑制细胞自噬和巨胞饮途径能显著抑制肿瘤生长。
南京大学附属鼓楼医院肝胆胰中心孙倍成教授研究团队长期以临床应用为导向,致力于发现肿瘤治疗的新靶点,开发创新的靶向药物和细胞药物。孙倍成教授表示:“我们正在争取为胰腺癌患者提供新的治疗选择。”













