蛋白与蛋白相互作用(PPI)组成复杂的细胞内网络,控制细胞的各项生命活动。常见的研究蛋白相互作用的技术手段主要依赖于生化方法如免疫共沉淀(Co-IP)等,仅能提供蛋白相互作用与否的信息,缺乏这些相互作用所发生的空间区域和动态过程信息。在细胞内直接观测蛋白相互作用的方法包括双分子荧光互补(BiFC)和荧光共振能量转移(FRET)等,能较好的在细胞内反映蛋白相互作用的亚区域。双分子荧光互补将荧光蛋白等分子在某些特定的区域分裂成两段,任何一段都无法单独发射荧光,连接相互作用的蛋白后,可以互补形成完整的荧光蛋白,发射荧光,指示蛋白相互作用状态。如果所分裂的荧光蛋白是光转换或光激活荧光蛋白,则可以在单分子和超分辨的层次上描述蛋白相互作用的信息。但是与现有各种商业化的荧光染料相比,荧光蛋白具有亮度低、光稳定性差、易漂白、多聚化等缺点。而最近几年发展起来的自连接标签蛋白(Self-labeling tags)可以结合染料,同时也能以融合蛋白的形式在活细胞内表达(genetic encode),成为非常有前景的取代荧光蛋白的工具。因此利用自连接标签蛋白实现双分子荧光互补能够克服使用荧光蛋白进行BiFC的缺点,能够在单分子和超高分辨水平追踪蛋白相互作用,提供更多有关相互作用的细节信息。
2021年3月19日,北京大学膜生物学国家重点实验室、生物医学前沿创新中心(BIOPIC)、北京大学国家生物医学成像科学中心(筹)、北京大学未来技术学院孙育杰课题组在Communications Biology杂志上在线发表了最新研究成果,论文题目为“TagBiFC technique allows long-term single-molecule tracking of protein-protein interactions in living cells”。作者开发了基于自连接标签HaloTag的TagBiFC技术,在细胞内单分子层次追踪了相互作用的一对转录因子c-Fos和c-Jun和染色质的动态相互作用过程。同时作者还利用TagBiFC对细胞内的核小体以及mRNA分子进行干扰更小地标记和追踪,以及对细胞内的微丝蛋白的无背景成像等。

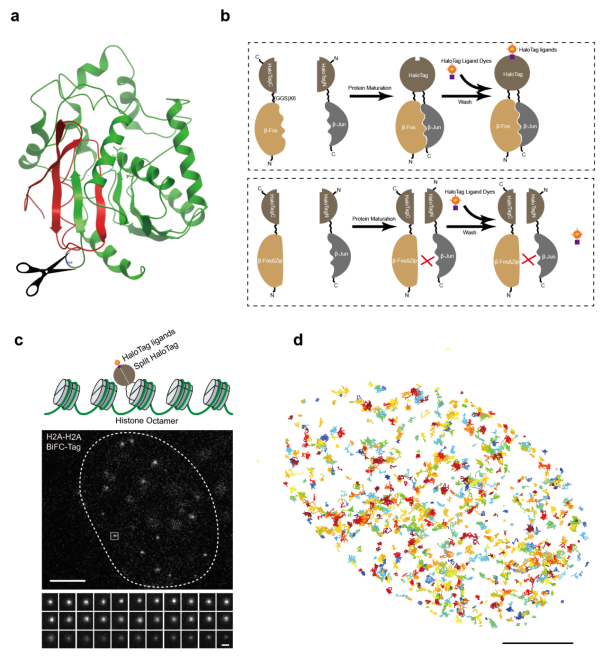
作者首先通过细胞内荧光扣留实验(fluorescent retention assay)结合流式分选对HaloTag不同的分裂位点进行筛选,发现P58 and G261位置的分裂蛋白在融合相互作用蛋白之后互补效率最高。作者进一步通过活细胞内成像对这些分裂位点的互补效果进行验证。随后,作者通过与分裂荧光蛋白mMaple3对比,表明TagBiFC具有更高的亮度,更高的单分子定位精度(10纳米),和更长的持续观测时间。
作者利用TagBiFC技术研究了二聚体AP-1转录因子家族,其在控制细胞增殖和分化中发挥关键作用。细胞内多个AP-1亚基同时表达,包括但不限于c-Fos、c-Jun、FosB、JunB、JunD、Fra1、Fra2、ATF2、ATFa和ATF3等。他们之间的复杂相互作用组合使得单独研究一个转录因子变得困难,无法确定该转录因子在特定的时间和空间内和哪个转录因子相互作用。而TagBiFC正好可以克服这个困难,研究一对转录因子的相互作用。作者通过单分子追踪分别比较了c-Fos和c-Jun的单体以及它们的异源二聚体、同源二聚体在细胞核内的扩散过程,发现c-Fos的染色质结合比例(37%)高于c-Jun(27%),同源二聚体(c-Fos和c-Fos, c-Jun和c-Jun)和异源二聚体(c-Fos和c-Jun)的染色质结合比例介于二者之间。作者还比较不同的转录因子组合在染色质DNA上的结合时间,发现不能形成二聚体的转录因子与染色质非特异性的结合时间与特异性结合时间没有改变,但稳定结合DNA的分子比例大幅下降(从20%下降到4%-5%)。
作者还利用TagBiFC标记了核小体的亚基组蛋白,实现了活细胞单分子水平追踪核小体的运动过程。作者发现几乎所有的核小体都在做受限扩散运动,但是不同的核小体之间运动的异质性非常大,运动轨迹的回转半径从60纳米到300纳米不等。这也论证了利用单分子研究核小体运动的必要性。利用这一系统,作者还研究了不同的细胞周期,不同的组蛋白变体,抑制转录等对核小体运动的影响。
TagBiFC还可用于对活细胞内的mRNA分子进行标记。传统的mRNA标记方法使用24个MS2适配子序列串联,置于mRNA的3’端。这种标记方法标签较大,可能会影响RNA分子的运动和代谢过程。使用TagBiFC只需要利用2个适配子MS2和PP7即可实现单分子层次对RNA分子的标记和追踪。通过比较发现,这种新的标记方法对RNA分子的运动影响较小(扩散系数差10倍),更能真实反映内源RNA分子的运动行为。最后,作者还利用TagBiFC的低背景特性,对细胞内的微丝骨架蛋白进行标记成像。
综合以上结果,TagBiFC 扩展了我们现有的工具包,能在纳米级和毫秒级的活细胞中可视化和跟踪生物大分子,在更加贴近生理状态下研究蛋白与蛋白相互作用。
北京大学生命科学学院邵世鹏博士(现任北京安贞医院助理研究员)为文章第一作者,北京大学膜生物学国家重点实验室、生物医学前沿创新中心(BIOPIC)、北京大学国家生物医学成像科学中心(筹)、北京大学未来技术学院孙育杰教授为本文通讯作者。北京大学博士生张宏晨、北京安贞医院曾勇教授,北京大学口腔医院李永亮博士,北京大学孙超英博士等对本文做出了重要贡献。
原文链接:
https://rdcu.be/cg4tZ













