cGAS可检测细胞质中DNA,感知微生物病原体的入侵。一旦与双链DNA结合,cGAS合成第二信使cGAMP。cGAMP结合并激活内质网定位的适配体蛋白STING,cGAMP结合的STING激活TBK1和IRF3,同时STING与IRF3协同激活NF- κB,诱导I型干扰素和其他炎性细胞因子的产生,控制并消除感染。cGAS被DNA激活并不具有序列特异性,细胞质中过量的自身DNA积累可激活cGAS促进自身炎症性疾病和细胞衰老。
越来越多的数据显示,有丝分裂期间,核膜破裂,cGAS与染色质紧密相关【1】。但是,染色质相关cGAS如何被调控,目前尚不清楚。生化研究显示,核小体通过将cGAS联结在组蛋白的酸性斑块上,抑制cGAS活性【2】。将cGAS与核小体结合的位点进行突变,则恢复cGAS活性,表明核小体联结可阻止cGAS感知自身DNA。但是,核小体仅在连接体DNA存在的情况下,部分抑制cGAS活性【3】,这表明存在其他的机制抑制cGAS活性。而当有丝分裂打破核质屏障时,核小体联结是否足以克服细胞质中cGAS的影响,目前尚不清楚。
近日,来自德克萨斯大学西南医学中心的陈志坚课题组在Science杂志发表文章 Phosphorylation and chromatin tethering prevent cGAS activation during mitosis,发现有丝分裂期间,cGAS活性被选择性抑制,同时揭示出两种并行的cGAS被抑制的机制:1)cGAS的N端被有丝分裂激酶(包括Aurora激酶B)过度磷酸化。cGAS的N端对感知核染色质至关重要,而对感知线粒体DNA是非必需的。过度磷酸化可阻断cGAS对染色质的感知。2)染色质结合cGAS的寡聚化被抑制,而这对于其激活是必需的。即有丝分裂过程中,这些机制保证染色质相关的cGAS是失活状态,有利于阻止自身免疫反应。

研究人员首先将细胞进行周期同步化,发现细胞周期的不同阶段都检测不到内源性cGAMP,提示即使染色质相关cGAS也处于未激活状态。利用外源DNA进行刺激,发现G1/S、S期、未同步细胞的cGAS都能产生高水平的cGAMP,而G2/M、M期细胞的cGAS不能被外源DNA激活。分析cGAS分布,发现不管细胞周期如何,大多数cGAS是核定位,或与染色质有关。外源DNA能激活非同步化细胞的核cGAS,但不能激活有丝分裂细胞的cGAS。即,当cGAS与有丝分裂染色质结合时,cGAS是失活的,并且有丝分裂细胞中染色质结合的cGAS不能被外源DNA激活。
那么,有丝分裂期间,cGAS处于失活状态的调节机制是什么?研究发现,细胞周期的有丝分裂阶段,cGAS被磷酸化。磷酸化位点有位于N端的Ser13、Ser37、Ser64、Thr69、Thr91、Ser116、Ser129和Ser143,以及位于催化结构域的Ser305。与非同步化细胞相比,有丝分裂细胞中N-末端丝氨酸和苏氨酸残基的磷酸化显著增加, Ser305的磷酸化(可抑制cGAS活性)没有改变。将N端的丝氨酸和苏氨酸残基都进行突变模拟磷酸化状态(cGAS20DE),可显著抑制cGAS的活性,而将其突变成丙氨酸(cGAS20A)则活性与野生型(cGASWT)相似。cGAS20A和cGASWT蛋白可与DNA相分离形成液滴,并催化cGAMP的合成,而cGAS20DE不行,即cGAS N末端的过度磷酸化抑制其活性。cGAS磷酸化的动力学与组蛋白H3S10磷酸化极为相关,而组蛋白H3S10是Aurora激酶B(AurB)的已知靶点,研究发现AurB可磷酸化cGAS的Ser13和Ser64位点。
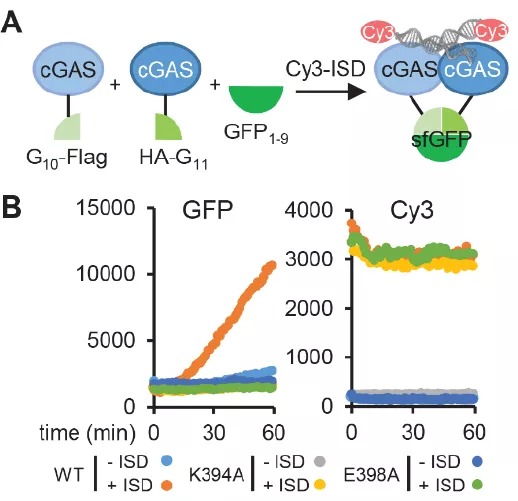
细胞周期停留在有丝分裂期,cGAS20A产生的cGMAP显著高于cGASWT,表明存在其他的机制来抑制有丝分裂过程的cGAS活性。近期的研究表明,快速分裂的细胞中,cGAS与染色质密切相关,核小体通过H2A-H2B的酸性斑块与cGAS结合。研究发现即使没有外源DNA,突变cGAS中与染色质结合的位点导致cGAS在非同步细胞中处于活化状态,而纯化的蛋白处于非活化状态,即细胞中染色质DNA可激活这些cGAS突变体。利用分裂GFP荧光报告系统,发现染色质结合的cGAS不能寡聚化,而细胞质的微核中cGAS可以进行寡聚化。进一步研究发现,N末端是cGAS感知染色质DNA的关键,这种感知可被有丝分裂的过度磷酸化所阻断。缺失N末端导致cGAS- ΔN组成性激活,cGAS- ΔN的N端具有线粒体靶向序列,将cGAS传递到线粒体,导致线粒体DNA(mtDNA)激活cGAS。
总的来说,研究发现了有丝分裂期间cGAS处于失活状态,并揭示了两种同时存在的机制,为理解cGAS激活提供了新的视角。
值得一提的是,武汉大学舒红兵院士团队于2020年4月在Cell Discovery杂志上发表的相关的研究工作【4】,总体结论(cGAS在有丝分裂期间被高度磷酸化,受CDK1的调控,活性受到抑制)与上述Science基本一致,而关于cGAS活性受核小体调控的相关机制此前有5篇CNS在同一时间被报道,此外还有一篇生物物理所章新政与许瑞明合作团队的工作,稍晚些时候发表在Cell Research杂志。
原文链接:
https://science.sciencemag.org/cgi/doi/10.1126/science.abc5386
参考文献













