2021年2月22日,Cell Stem Cell 期刊发表了来自中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红/张磊/程涛团队联合南方医科大学王栋团队的文章Hematopoietic stem cell heterogeneity is linked to the initiation and therapeutic response of myeloproliferative neoplasms,首次将造血干细胞异质性与血液肿瘤发病与治疗关联起来,指出肿瘤突变伴随的造血干细胞异质性亚群是导致不同血液肿瘤发生的原因之一。

JAK2V617F突变的骨髓增殖性肿瘤(MPN)根源于造血干细胞,主要分为3种亚型(图1):真性红细胞增多症(PV),以红系增生为显著特点并伴髓系各系增生;原发性血小板增多症(ET),以血小板和巨核细胞增多为主要特征;原发性骨髓纤维化(PMF),以进行性骨髓纤维化为特征【3】。同一造血干细胞突变(JAK2V617F)引发不同的疾病表型使得骨髓增殖性肿瘤成为研究造血干细胞异质性与疾病关联的理想模型。
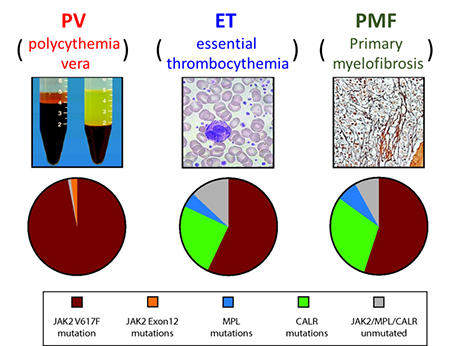
图1 骨髓增殖性肿瘤分类及主要驱动突变分布【4】
研究者采取了单细胞转录组(RNA-seq)与单细胞genotyping联合分析策略(Single-cell RNA-seq coupled with mutation detection),也就是说在同一个单细胞中既能检测细胞的转录组又能准确得知其突变信息(纯合或杂合突变),研究了JAK2V617F+真性红细胞增多症、原发性血小板增多症患者的造血干细胞(图2)。发现在初诊的原发性血小板增多症患者的造血干细胞中,突变细胞具有明显巨核偏好造血干细胞(megakaryocyte-primed HSCs)特征且增殖与巨核分化潜能更强;但在真性红细胞增多症患者中该亚群趋于正常。因此,原发性血小板增多症患者血小板增多是单个巨核偏好造血干细胞分化能力增强及该群体扩大两方面所致。更进一步,研究者在初诊的原发性血小板增多症患者的造血干细胞中发现干扰素信号水平上升,提示了促进突变细胞巨核分化的潜在微环境因素。单细胞功能实验证实,原发性血小板增多症患者突变的造血干细胞对低浓度干扰素刺激更敏感,更易向巨核谱系分化;与之相反,真性红细胞增多症患者的突变造血干细胞对干扰素信号较不敏感。机制上, JAK2突变及干扰素信号升高,促使突变细胞的代谢状态由低效糖酵解转化为高效氧化磷酸化,从而为干细胞增殖和分化提供了足够的能量及必要代谢产物【5】。随后通过激活PI3K-AKT-mTOR,JAK-STAT和NF-κB等信号通路实现了突变的巨核偏好造血干细胞的急剧增殖及向血小板的高效分化【6,7】。因此,突变的巨核偏好造血干细胞是原发性血小板增多症疾病发生的干细胞基础,而升高的炎症信号水平(干扰素信号)则是该亚群细胞增殖分化的外部动力,内外作用最终导致了疾病发生发展(图3)。
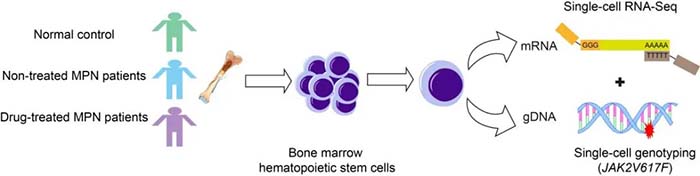
图2 单细胞转录组(RNA-seq)与单细胞genotyping联合分析骨髓增殖性肿瘤造血干细胞异质性
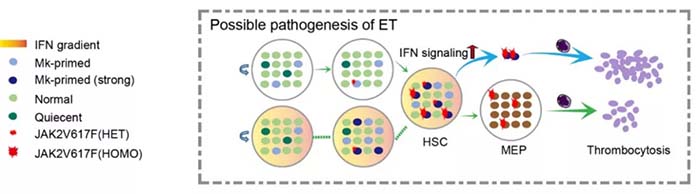
图3 造血干细胞异质性介导的JAK2V617F+原发性血小板增多症发病机制
干扰素-α(IFNα)同时是骨髓增殖性肿瘤患者的一线治疗药物,其可在临床症状,外周血象,组织病理指标等多方面对病症进行缓解,少数患者可达到一定程度的分子学缓解。对骨髓增殖性肿瘤疾病模型小鼠的研究发现,干扰素可通过诱导突变造血干细胞凋亡或衰竭来清除突变细胞【8,9】。但是,在患者中干扰素治疗的细胞基础、分子机制及与造血干细胞异质性之间的联系尚未可知。为此,研究者筛选了单独使用干扰素治疗或联合羟基脲治疗的JAK2V617F+原发性血小板增多症患者进行了单细胞RNA-Seq联合单细胞genotyping。该研究发现治疗后JAK2V617F+原发性血小板增多症患者中突变的巨核偏好造血干细胞群体比例有所下降。有意思的是,治疗后纯合突变(HOMO)和杂合突变(HET)造血干细胞行为有所不同。杂合突变型造血干细胞凋亡作用增强,而纯合突变型造血干细胞似乎通过恢复TSC-mTOR信号通路而重新进入休眠静息状态 (图4)。由此,该研究不但阐明了药物治疗的细胞基础是让巨核潜能造血干细胞亚群减小,而且发现其分子机制主要是通过诱导突变细胞凋亡或迫使其进入休眠。同时,也阐明可能导致疾病复发的细胞机制,即这些休眠的突变细胞是疾病复发的根源。
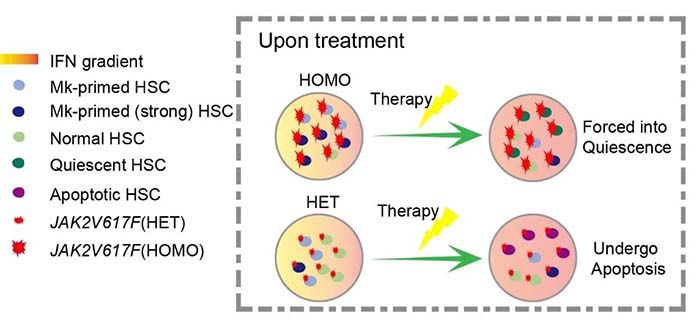
图4 JAK2V617F+原发性血小板增多症治疗反应
总之,该研究表明造血干细胞异质性是具有相同起始突变的骨髓增殖性肿瘤产生不同亚型的基础之一,提示干细胞群体中不同异质性亚群能够影响血液肿瘤的发生、治疗及复发过程。从干细胞异质性角度出发,该研究提示组织干细胞异质性可能与多种肿瘤的临床表现与治疗反应相关,是其发病与治疗的潜在机制之一。
中国医学科学院血液病医院(中国医学科学院血液学研究所)研究助理佟静媛、医生孙婷、助理研究员马士卉、博士生赵艳红、主治医师鞠满凯为该研究论文的第一作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红研究员、血栓止血中心张磊主任医师、实验血液学国家重点实验室主任程涛教授和南方医科大学王栋教授为该论文的通讯作者。
黄刚 教授(辛辛那提儿童医学中心)
通过在单细胞水平同时检测转录组以及细胞突变的单细胞测序技术,这篇新发表于Cell Stem Cell的论文揭示了肿瘤突变、造血干细胞异质性与骨髓增殖性肿瘤的发病机制和治疗反应的关系。这个研究对血液肿瘤,乃至实体肿瘤的发病、治疗、复发等方面均有几点重要的启示:
首先,本研究发现JAK2V617F+骨髓增殖性肿瘤亚型之一原发性血小板增多症患者中造血干细胞异质性发生了显著改变,巨核偏好造血干细胞的潜能增强,群体变大。这种变化主要归功于突变细胞。同一JAK2突变导致三种不同的骨髓增殖性肿瘤亚型是本领域的根本科学问题。这个研究指出原发性血小板增多症患者的病发的细胞基础之一可能是突变的巨核偏好造血干细胞。同时,他们发现初诊的原发性血小板增多症患者的造血干细胞中干扰素信号水平升高,而突变的巨核偏好造血干细胞表现出对干扰素信号的超敏性。在干扰素的刺激下其向巨核和血小板分化能力增强。由此JAK2突变和体内炎症环境(高干扰素信号水平)为巨核偏好造血干细胞的进一步分化提供了增殖及分化的种子与土壤,最终导致了疾病发生。该研究不但为解答MPN领域长期以来的难题提供了新的可能性,而且指出干细胞异质性是同一突变导致多种不同肿瘤亚型发生的根源之一。
其次,对比治疗前后原发性血小板增多症患者的造血干细胞后发现,治疗后巨核偏好造血干细胞群体变小。杂合突变细胞治疗后进入凋亡模式,而纯合突变细胞则表现出明显的休眠和静息特征。由此药物治疗的分子机制主要是促使突变细胞凋亡。这些进入休眠的突变细胞为疾病的复发提供了源泉和火种。该研究解释了治疗后患者的反应,为其提供了重要的细胞及分子学基础。部分患者在治疗后,其突变负荷都会降低;但一旦中断治疗,患者极易复发。原因很可能是残留的突变造血干细胞在炎症环境下,迅速进入增殖和分化。由此,针对该类患者,在现有的治疗基础上联合抗炎药物是一个潜在的新治疗策略。
总之,这个研究不仅对领域内重要难题-MPN发病机制层面提供了新的角度,还提示了现有的治疗手段不能根治该病,联合抗炎药物有可能取得更好的治疗效果。非常期待进一步的临床前以及临床研究。
杨逢春 教授(德克萨斯大学圣安东尼奥健康科学中心)
造血干细胞是一组功能异质性的群体, 具有不同谱系分化偏好性。但迄今为止, 造血干细胞异质性对血液肿瘤病理发生的意义仍不明确。利用JAK2V617F+骨髓增殖性肿瘤模型, 石莉红/张磊/程涛/王栋团队首次报道了原发性血小板增多症患者中携带突变的造血干细胞表现出了明显的巨核谱系偏好性,而真性红细胞增多症患者突变造血干细胞并没有表现出明显的谱系偏移,提示突变的巨核偏好造血干细胞是导致JAK2V617F+ 原发性血小板增多症发病的重要因素之一。在既往发现的JAK2V617F突变负荷、不同STAT的激活、体细胞突变顺序以及遗传背景等影响JAK2V617F+ 骨髓增殖性肿瘤表型的因素外,本研究从造血干细胞异质性的角度切入,揭示其与骨髓增殖性肿瘤的临床相关性,为该类疾病的发病机制的研究提供了新思路。更为重要的是,该研究提示组织干细胞异质性有可能是肿瘤临床症状差异的细胞基础,为其它非血液肿瘤的发病机制研究提供了重要参考,指明了新的研究方向。
本研究的另一个有趣的发现是干扰素信号在原发性血小板增多症疾病的发生、治疗及复发中具有多面性。在髓系肿瘤发生过程中,干扰素信号升高是突变造血干细胞向巨核分化的始作俑者之一。携有突变的造血干细胞对低浓度干扰素刺激极为敏感,并通过激活STAT1介导的信号通路促使其向巨核分化。而另一方面, 干扰素是治疗JAK2V617F+ 骨髓增殖性肿瘤的一线药物。为了研究干扰素的治疗机制, 研究者对比了治疗前后JAK2V617F+原发性血小板增多症患者(单独使用干扰素治疗或联合羟基脲治疗)的造血干细胞功能,发现治疗后突变巨核偏好造血干细胞比例减少,并主要是通过促使纯合突变细胞进入休眠状态及诱导杂合突变细胞凋亡来实现的。该结果对于JAK2V617F+ 原发性血小板增多症的临床治疗有多重意义:异常升高的干扰素信号是促进原发性血小板增多症疾病发生的必要因素之一,而长期、治疗剂量的干扰素α仅能遏制但不能彻底消除突变细胞,提示干扰素治疗无法根除该疾病。该研究为JAK2V617F+ 原发性血小板增多症患者需要长期服用干扰素提供了理论依据,也解释了部分患者中断治疗后快速复发的细胞分子基础,即休眠的突变细胞重新“觉醒”。基于干扰素在疾病起始和治疗中复杂的双面调控作用,干扰素联合其它抗炎药物有望成为治疗JAK2V617F+ 原发性血小板增多症的新策略。
最后,与初诊的JAK2V617F+ 原发性血小板增多症不同,初诊时JAK2V617F+真性红细胞增多症患者并未发现干扰素信号的异常,提示这两种MPN亚型尽管携带有相同的驱动突变但其发病机制仍有所差异,有待针对不同亚型的具体发病机制来进一步优化治疗策略,从而开发出更加精准化的治疗手段。
综上,该研究通过将MPN的发病和治疗效应与造血干细胞的异质性联系起来,在MPN的发病和治疗机制方面提供了重要的发现,并指出了针对骨髓增殖性肿瘤的新的治疗策略。
值得一提的是,在同期CSC上,来自哈佛医学院的Sahand Hormoz、EMBL-EBI的Isidro Cortes-Ciriano和Dana-Farber癌症研究所的Ann Mullally合作发表了背靠背文章Reconstructing the Lineage Histories and Differentiation Trajectories of Individual Cancer Cells in Myeloproliferative Neoplasms。

该研究计算推演了2名JAK2V617F突变的原发性血小板增多症患者造血干细胞及多潜能造血祖细胞(MPP)中JAK2突变的演化发展史,诧异地发现早在骨髓增殖性肿瘤诊断数十年前患者的造血干细胞中就已经获得了JAK2V617F基因突变。在经历稳定期后(跨度可达数十年),突变的造血干细胞在未知因素的影响下获得了明显的选择优势,呈指数级增长。该研究不但溯源驱动突变获得、突变细胞扩增的过程及路径,同时还解析了突变干细胞增殖和分化动力学与不含突变的野生型细胞的不同之处。总之,通过描绘肿瘤突变发生发展的历史纪事年鉴,该研究使我们得以窥探疾病诊断之前突变细胞是如何获得、积累和扩增的,不但对骨髓增殖性肿瘤患者,而且对其它肿瘤的早期诊断、早期预防和干预具有重要启示。该研究还利用单细胞转录组测序联合单细胞genotyping测序技术发现JAK2V617F+骨髓增殖性肿瘤患者中突变的CD34+造血干祖细胞展现出了向巨核-红细胞命运发展的谱系偏好性。
两篇研究互为补充,分别在干细胞、祖细胞水平将谱系偏好和MPN疾病的临床特征联系起来,为骨髓增殖性肿瘤的发病机制研究提供了新理论。许多肿瘤始于单个细胞的基因突变。未来,单细胞转录组联合单细胞基因组分析的方法,不但有助于发现致病性的异质性细胞亚群而且还有利于追踪驱动突变发生及分化轨迹,对肿瘤的研究具有重要价值。
原文链接:
https://doi.org/10.1016/j.stem.2021.01.018
https://doi.org/10.1016/j.stem.2021.02.001
参考文献
1.Goodell, M.A., H. Nguyen, and N. Shroyer, Somatic stem cell heterogeneity: diversity in the blood, skin and intestinal stem cell compartments. Nat Rev Mol Cell Biol, 2015. 16(5): p. 299-309. 2.Jacobsen, S.E.W. and C. Nerlov, Haematopoiesis in the era of advanced single-cell technologies. Nat Cell Biol, 2019. 21(1): p. 2-8. 3.Nangalia, J. and A.R. Green, Myeloproliferative neoplasms: from origins to outcomes. Hematology Am Soc Hematol Educ Program, 2017. 2017(1): p. 470-479. 4.Nangalia, J. and T.R. Green, The evolving genomic landscape of myeloproliferative neoplasms. Hematology Am Soc Hematol Educ Program, 2014. 2014(1): p. 287-96. 5.Verovskaya, E.V., P.V. Dellorusso, and E. Passegué, Losing Sense of Self and Surroundings: Hematopoietic Stem Cell Aging and Leukemic Transformation. Trends Mol Med, 2019. 25(6): p. 494-515. 6.Hao, S., C. Chen, and T. Cheng, Cell cycle regulation of hematopoietic stem or progenitor cells. Int J Hematol, 2016. 103(5): p. 487-97. 7.Pietras, E.M., M.R. Warr, and E. Passegué, Cell cycle regulation in hematopoietic stem cells. J Cell Biol, 2011. 195(5): p. 709-20. 8.Hasan, S., et al., JAK2V617F expression in mice amplifies early hematopoietic cells and gives them a competitive advantage that is hampered by IFNα. Blood, 2013. 122(8): p. 1464-77. 9.Mullally, A., et al., Depletion of Jak2V617F myeloproliferative neoplasm-propagating stem cells by interferon-α in a murine model of polycythemia vera. Blood, 2013. 121(18): p. 3692-702.
文章来源:bioart













