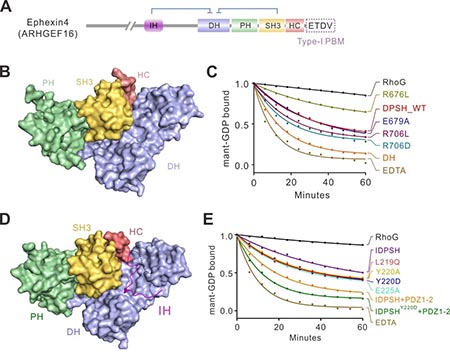
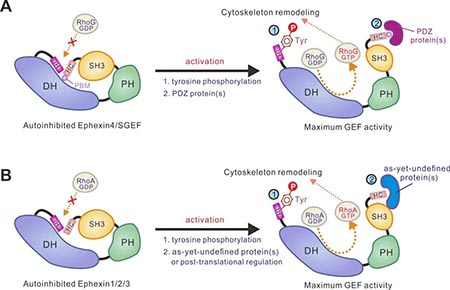
近日,上海交通大学Bio-X研究院朱金伟团队与中国科学技术大学王朝团队合作在PNAS在线发表题为Double inhibition and activation mechanisms of Ephexin family RhoGEFs的研究论文,首次揭示了Ephexin家族RhoGEF双重自抑制及激活的分子机制。本项工作发现Ephexin4 RhoGEF的自抑制包含两个部分:1)其羧基端的SH3-HC串联结构域能够与GEF酶活中心-DH-PH结构域相互作用,从而阻碍了RhoG的进入,抑制了催化反应;2)其氨基端的一段保守的多肽序列(IH多肽序列)也能结合到DH结构域上,抑制Ephexin4的酶活。该工作运用结构生物学方法分别研究了Ephexin4的羧基端自抑制和双重自抑制的三维结构信息,详细阐明了Ephexin4自抑制的结构基础和分子机理(图1)。有趣的是,结构分析显示自抑制界面上关键残基(如R706)在肿瘤中发生突变(R706L),这一突变将打破自抑制构象,从而激活Ephexin4的酶活。生化实验也证实了这一结构分析(图1)。本工作进一步探索了Ephexin4自抑制构象激活的可能机制。作者发现,DLG1或Tip1蛋白的PDZ结构域可以结合Ephexin4羧基末端的PDZ结合序列(PDZ-binding motif,PBM);这一相互作用能够有效的激活Ephexin4羧基端的自抑制。Ephexin家族蛋白氨基端的IH自抑制多肽序列“LY220Q”中的Tyr220据报道能够被Src等酪氨酸激酶磷酸化。结构分析及生化实验证实这一磷酸化将大大降低抑制多肽与DH结构域的相互作用,从而打开自抑制构象(图2)。重要的是,上述两种Ephexin4的激活机制在细胞里也是同样的工作机制。进一步研究表明,Ephexin家族其他蛋白以及另一个RhoG-GEF-SGEF也采用同样的自抑制模式(图2)。图2. Ephexin家族RhoGEF双重自抑制和激活分子机制示意图综上,本项工作通过综合运用结构生物学、生物化学和细胞生物学方法,阐明了Ephexin家族蛋白双重自抑制和激活的分子机理,为相关神经系统疾病和肿瘤的发病机制提供了可靠的结构阐释,并为相关药物的开发提供了基础。https://www.pnas.org/content/118/8/e2024465118