单纯疱疹病毒(HSV)是疱疹病毒的典型代表,由于感染急性期发生水疱性皮炎即单纯疱疹而得名。根据抗原特性的差别,HSV分为HSV-1和HSV-2两种血清型。人是单纯疱疹病毒(HSV)的天然宿主。HSV在人群中感染极为普遍,其中I型单纯疱疹病毒(HSV-1),是全世界最常见的人类病毒之一,全世界50-90%的人口曾感染过该病毒。HSV病毒感染仍然是尚未被攻克的医学难题,至今,既无疫苗可用,也无药物可以根治。
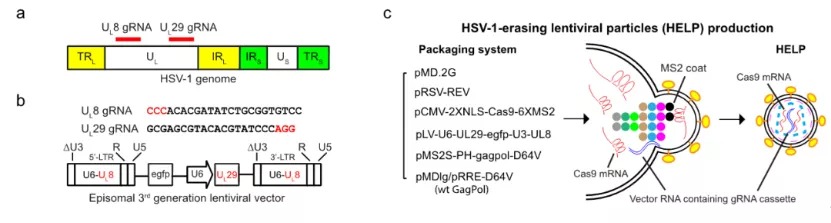
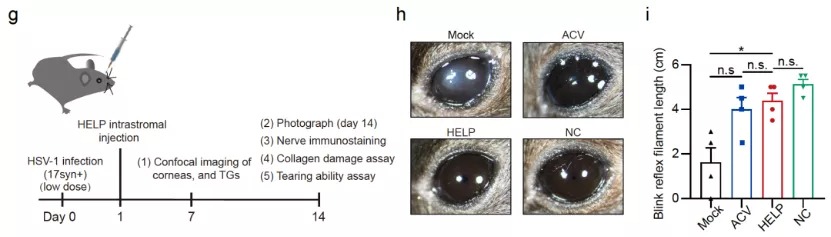
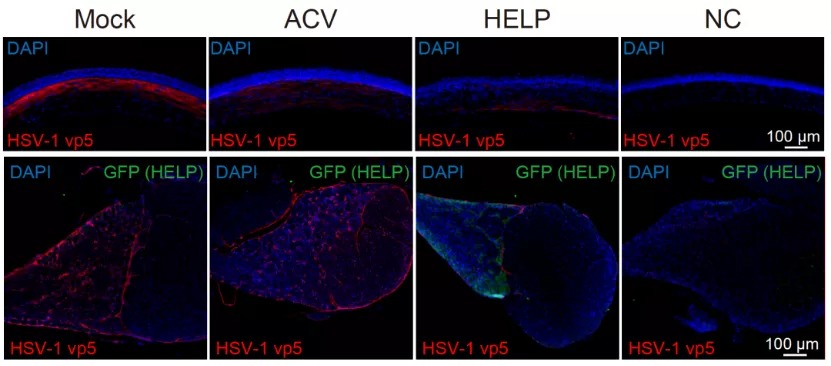
HSV-1的感染可引起多种疾病,包括单纯疱疹性脑炎,如果不及时治疗,死亡率很高。近年来,HSV-1感染也被认为是导致帕金森病和阿尔兹海默症的重要因素。眼角膜的HSV-1感染可引起疱疹性基质性角膜炎(HSK),这是感染性失明的首要原因。HSV-1感染角膜后,可在三叉神经节潜伏,形成病毒库。在全球范围内,估计每年有150万个角膜HSV复发案例,至少造成4万人失明。在临床上,存在不少病毒性角膜炎患者接受角膜移植恢复透明不久,HSV病毒颗粒再次从神经节释放导致角膜移植失败的案例。目前HSV-1感染导致的病毒性角膜炎的一线治疗药物是阿昔洛韦(ACV),然而,阿昔洛韦问世以来的长达半个世纪的时间内,仍然没有出现一种可以清除角膜和三叉神经节内病毒的医疗技术。因此,病毒性角膜炎至今都是无法根治的眼科疾病。因此,如何在保证安全的基础上,直接降解病毒的基因组,甚至从根源的三叉神经节内有效清除潜伏的HSV成为了一个新的研究方向。在一次哈佛-波士顿学者的学术活动上,基因编辑与病毒学背景的蔡宇伽教授遇见了研究角膜病的临床医生洪佳旭。双方经过交流后,发现两人不谋而合都在进行病毒性角膜炎的基因编辑治疗探索。彼时,蔡宇伽正为临床样品发愁,且对于该技术将来能否应用到临床并不确信、对于临床上如何给药也没有答案;而洪佳旭则苦恼没有合适的基因编辑递送系统,所使用的AAV在动物上没有实现治疗效果。双方起初有些担心竞争,但各自回去思考之后,很快决定联手去攻克病毒性角膜炎这个医学难题。2021年1月11日,上海交通大学系统生物医学研究院蔡宇伽教授和复旦大学附属眼耳鼻喉科医院洪佳旭主任合作,在Nature Biotechnology 杂志上发布了一项题为:Targeting herpes simplex virus with CRISPR–Cas9 cures herpetic stromal keratitis in mice的研究论文,报道了联合团队使用新型递送技术利用CRISPR–Cas9靶向单纯疱疹病毒治愈小鼠疱疹性基质性角膜炎的研究。该研究基于蔡宇伽团队前不久开发的我国原创性基因治疗递送技术——类病毒体-mRNA递送平台(蔡宇伽团队发明一种介于病毒载体与非病毒载体之间的类病毒体递送技术)(VLP-mRNA)。VLP-mRNA技术近日获得了国家专利授权,并成功实现了成果转化。使用该递送平台,研究团队进行了CRISPR体内基因编辑治疗病毒性角膜炎的临床前研究,有效抑制了HSV-1病毒复制,成功治愈了疱疹性角膜炎的模型小鼠,防止了病毒复发。研究团队将该技术命名为HELP(HSV-1-Erasing Lentiviral Particles)。HELP技术突破了现有的阿昔洛韦等传统小分子药物的局限,可以直接清除体内潜伏的病毒,有望给病毒性角膜炎患者带来根本上的治愈。研究团队首先设计了两条靶向HSV-1生命周期中的关键基因的向导RNA(gRNA),以使Cas9可以在HSV-1基因组上直接剪切,造成其降解。为了使得基因编辑更为安全,研究人员使用了新型的基因编辑递送技术,即VLP-mRNA,来递送Cas9 mRNA。VLP-mRNA可以同时递送Cas9和gRNA,克服了长期以来AAV递送携带能力过小的问题,以及长时间表达Cas9的带来的安全风险。该技术可以最大限度的减少CRISPR基因编辑的脱靶风险,是目前较为先进的体内基因编辑递送技术,有望引领基因编辑的临床应用。为了证明HELP的抗病毒效果,蔡宇伽和洪佳旭研究团队采用了预防型、治疗型和复发型三种不同的小鼠感染模型。研究人员发现,HELP在这三种不同的HSV感染模型上,均有效地阻止了HSV-1的复制,并防止了疱疹性基质性角膜炎的发生(图2)。图2:HELP在病毒感染的治疗模型上的治疗效果展示令人兴奋的是,研究人员发现了HELP可以从角膜逆行运输到三叉神经节,清除HSV-1病毒库的证据(图3)。作为对照,传统药物阿昔洛韦(ACV)尽管也可以抑制角膜内的病毒复制,却无法对三叉神经节内的病毒起到任何限制作用(图3)。此外,研究者利用捐献者角膜也观察到HELP可以有效的清除人角膜内的HSV-1病毒。CRISPR基因编辑技术的诞生为许多疾病治疗带来了全新见解,但其潜在脱靶性在很大程度上限制了临床应用的进度,考虑到脱靶性可能带来的安全性问题,研究团队进行了全基因组测序,并未发现HELP引起脱靶现象。这可能跟HELP技术是以mRNA的形式完成Cas9的递送有关。基于mRNA递送的CRISPR,基因编辑酶Cas9在体内停留时间很短。因而,基因编辑是瞬时的,可最大限度的降低脱靶风险和减少免疫反应。据悉,审稿专家认为该工作的结果通过多种技术手段相互印证,罕见地表达出高度赞赏:the quality of the data is near exceptional;make an excellent contribution to the field。复旦大学附属眼耳鼻喉科医院的洪佳旭主任在伦理委员会的论证及许可下,目前正在主持开展HELP技术应用于难治性病毒性角膜炎的临床研究。总的来说,本研究有力地支持了HELP作为一种全新的抗病毒疗法的临床潜力,为难治性病毒性角膜炎患者带来光明的希望。上海交通大学系统生物医学研究院博士生尹笛、凌思凯为该论文的共同第一作者,上海交通大学系统生物医学研究院蔡宇伽教授和复旦大学附属眼耳鼻喉科医院洪佳旭主任为共同通讯作者,复旦大学附属眼耳鼻喉科医院、上海交通大学附属瑞金医院、丹麦奥胡斯大学的科学家参与了本研究,并做出了重要贡献。中华医学会眼科分会角膜病学组组长、山东省眼科医院院长史伟云教授的评价:“长期以来,反复发作的病毒性角膜炎是临床治疗的难点。现有抗病毒与抗炎治疗并不能从根本上解决病毒潜伏于三叉神经元的问题。上海交通大学蔡宇伽教授和复旦大学洪佳旭主任在国际顶尖期刊Nature Biotechnology发表的原创型的基因编辑治疗技术为病毒性角膜炎的根治提供了新的解决思路,值得期待。”
中山大学中山眼科中心副主任袁进教授认为:“将基因编辑运用于单疱病毒性角膜炎的治疗无疑是0到1的创新突破。该研究证实在单疱病毒性角膜炎动物模型上通过基因编辑可抑制HSV病毒的转运和复制,有希望成为一种病毒性角膜炎的全新疗法,解决病毒性角膜炎复发这一临床难题。”阿斯利康(瑞典)基因治疗项目高级科学家李松沅博士认为“革命性的基因编辑技术带来了从根本(DNA)层面上解决疾病成因的可能性。随着基因编辑工具的不断发展成熟,如何将这些工具更好地递送进入病灶内,并降低这些工具在细胞中产生的长期风险,成为了基因治疗领域日益突显的新挑战。蔡宇伽教授开发的VLP-mRNA递送平台,创性地将类病毒颗粒(VLP)和基因编辑工具的递送结合起来,在病毒性角膜炎的动物模型中实现了有效且安全的基因编辑。VLP-mRNA的出现解决了传统的AAV递送平台存在的包装尺寸限制问题,且将基因编辑工具的表达载体由长期存在的DNA替换成了瞬时表达mRNA,极大地提高了使用基因编辑工具的灵活性和安全性。”https://doi.org/10.1038/s41587-020-00781-8