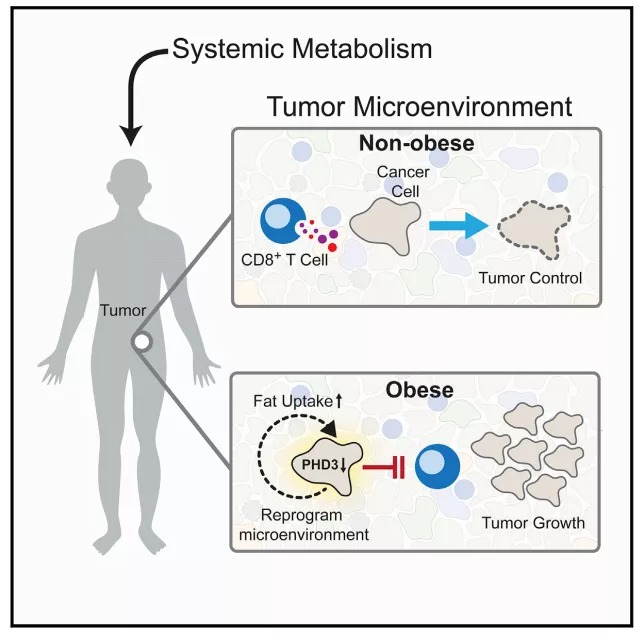
肥胖在西方世界是一种流行病,也是至少13种癌症的危险因素。肥胖导致机体代谢的系统性紊乱,导致血脂异常、高胆固醇血症、胰岛素抵抗、激素水平改变和炎症基线改变【1】。与肥胖相关的细胞水平改变例如肠上皮细胞的转录和表观遗传改变,有助于结肠直肠癌的发生和进展【2,3】。以往对肥胖和癌症的研究主要集中在肿瘤的内在效应或肿瘤细胞的内分泌调节轴上,而肥胖引起的全身代谢改变对肿瘤局部微环境(tumor microenvironment, TME)免疫细胞的影响尚未见报道。TME是一种独特的代谢生态环境,包括细胞成分(肿瘤细胞、免疫细胞和基质细胞)以及肿瘤组织间隙的内容物。肿瘤细胞代谢的一个特点是营养消耗增加,以满足能量、合成代谢和促进生存的需求【4】。活化的T细胞高度增殖,依赖特定代谢途径维持T细胞效应器功能。鉴于实体肿瘤的血液供应有限,肿瘤细胞的高营养消耗可能对肿瘤内T细胞的代谢需求构成障碍【5】。众所周知,肿瘤细胞代谢会以抑制抗肿瘤免疫的方式改变局部代谢格局的许多方面。然而,全身代谢如何影响TME内的局部代谢,以及肥胖如何影响肿瘤和免疫细胞之间的相互作用尚不清楚。2020年12月9日,来自哈佛医学院的Arlene H. Sharpe课题组和Marcia C. Haigis课题组在Cell 杂志上合作发表了一篇题为 Obesity Shapes Metabolism in the Tumor Microenvironment to Suppress Anti-Tumor Immunity 的文章,在这项研究中,作者利用代谢学、蛋白质组学和基因组学的方法,以及多重组织成像,通过小鼠肿瘤模型系统地剖析了高脂饮食(high-fat diet, HFD)诱导的肥胖如何重塑TME的代谢。此外,使用scRNA-seq描述TME中免疫亚群对肥胖的代谢反应,绘制出HFD诱导的肥胖与肿瘤免疫细胞在单细胞分辨率水平上的动态图谱。最后,作者提出阻断肥胖小鼠肿瘤细胞的代谢重编程可提高抗肿瘤免疫能力以及利用新陈代谢或能改善癌症免疫治疗的观点。

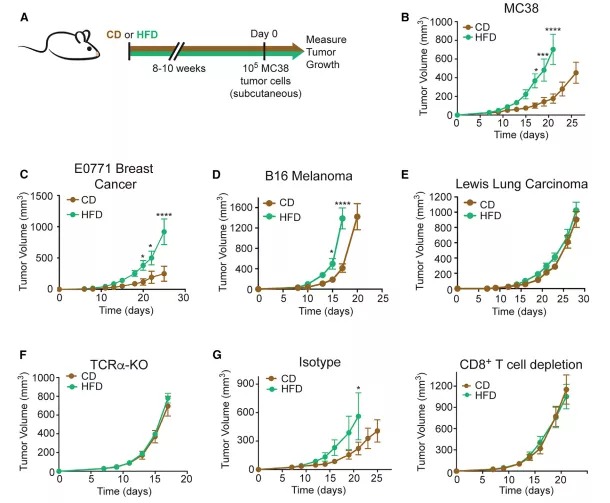
为了在小鼠中建立人类肥胖模型,作者将5周龄小鼠随机分为正常饮食组(control diet, CD)和HFD组,并于喂食8-10周后,在HFD小鼠中检测出全身性肥胖相关的代谢水平改变。随后,作者将不同程度免疫原性的肿瘤细胞注射到小鼠体内,观察到两组小鼠体内的肿瘤生长速度存在差异,例如高免疫原性原位E0771乳腺肿瘤在HFD小鼠中生长更快,而低免疫原性LLC肿瘤的生长率不随饮食而改变。为了探讨CD组小鼠肿瘤生长率降低是否是由于T细胞的控制,作者将MC38(小鼠结肠癌细胞)肿瘤植入TCRα-KO( T cell receptor-α knockout)小鼠体内,与HFD相比,正常饮食的TCRα-KO小鼠的MC38肿瘤生长率没有差异,类似地,在缺乏CD8+ T细胞的小鼠中,肿瘤生长率也没有饮食依赖性变化。
为了了解HFD喂养如何改变MC38肿瘤的免疫状况,作者使用流式细胞术分析肿瘤植入后10-14天后肿瘤体积相似时肿瘤浸润的免疫细胞群,并发现CD8+ T细胞是MC38 TME中受HFD影响最大的免疫细胞类型。根据T细胞功能指标例如Ki67,GZMB和PD-1水平检测结果,HFD可以引起CD8+ T细胞的活性和功能降低。随后,作者利用scRNA-seq技术在单细胞分辨率水平绘制肥胖条件下的代谢改变谱,鉴定出TME中的免疫细胞对HFD有独特的代谢适应反应,且T细胞的代谢差异明显,集中表现为中心碳代谢途径的改变。而对于肿瘤细胞的杀伤,CD8+ T细胞需要直接的细胞接触和足够的代谢资源。为此,作者试图了解肥胖是否影响肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)在TME中的位置,以及T细胞在肿瘤中的位置是否与肿瘤内代谢生态位的变化有关。作者通过循环免疫荧光(cyclic immunofluorescence, CyCIF)绘制TME中细胞的位置和状态,发现与CD相比, HFD肿瘤中CD8+和CD4+ T细胞与糖酵解标记物GLUT1之间的重叠减少,提示HFD改变了肿瘤内的代谢生态位相互作用,并影响了局部T细胞的浸润模式。CD8+ T细胞依赖于许多与肿瘤细胞相同的“燃料”来源和代谢途径来支持增殖、生存和效应功能,两者在代谢资源的争夺上可能会存在“拉锯战”。通过对基因表达模式的分析,作者发现HFD中肿瘤细胞和CD8+ T细胞在脂质代谢方面存在差异。通过进一步的基于串联质谱标签的定量蛋白质组学分析,作者发现脂肪酸代谢和氧化磷酸化途径富集于HFD肿瘤细胞,HFD通过诱导转运体、脂肪酸结合蛋白和参与线粒体β氧化的蛋白质来支持肿瘤中的脂肪利用,而肿瘤细胞对脂肪酸的摄取增强可能导致T细胞在TME中缺乏脂肪酸,加之HFD中的IFNγ反应相对于CD较低,这些或许可以解释为什么CD8+ T细胞活性降低以及浸润减少。根据上述结果,作者假设阻止HFD诱导的代谢改变可以恢复CD8+ T细胞的反应,并防止HFD引起的肿瘤生长增加。为了验证这一观点,作者在MC38细胞中过表达HFD-MC38细胞中主要改变的代谢调节因子之一PHD3,确实显著增加了HFD小鼠中CD8+ T细胞的浸润,相反,显著降低了肿瘤细胞对脂肪酸的摄取以及肿瘤生长速率,提示维持PHD3在MC38肿瘤细胞中的高表达可提高HFD小鼠的抗肿瘤T细胞反应。与此一致的是,作者分析了TCGA上结直肠癌RNA序列数据集与相应的BMI数据,在BMI为30 kg/m2的肥胖患者的肿瘤中,PHD3的表达显著降低,与结直肠癌患者的正常组织相比,癌症中PHD3的表达也明显降低。基于此,作者假设肥胖可能会减少人类肿瘤中T细胞的浸润或功能,通过分析PHD3转录水平与CD8+ T细胞介导的免疫和炎症标记物之间的关系,MHC-I和GZMB与PHD3在多种癌症类型中的表达呈显著正相关,表明低水平PHD3肿瘤则炎症程度较轻。与此同时,作者在五种癌症数据集中验证低水平PHD3样本在冷肿瘤中显著富集,提示PHD3下调发生在人类癌症中,并与免疫力下降有关。总的来说,这项研究揭示肿瘤细胞对HFD的适应由于脂肪酸分配的改变和必需代谢产物的局部耗竭而导致T细胞功能障碍,尤其是饮食压力可以放大肿瘤代谢的“拉锯战”,突出了肿瘤内局部代谢的复杂性,并证明了将肿瘤内细胞群之间的代谢相互作用作为调节免疫控制肿瘤生长的一个因素是至关重要的。因此,在没有微环境压力的情况下,对培养的肿瘤细胞进行研究,就不能完全了解肿瘤代谢重编程的影响。相反,为了充分利用患者靶向代谢的能力,研究者必须了解全身代谢、TME变化之间的相互作用,以及对肿瘤和免疫细胞代谢可能产生的不同影响。进一步了解系统代谢如何影响TME中的营养分配和免疫功能,可能会对针对癌症代谢和抗肿瘤免疫的治疗干预产生影响。https://doi.org/10.1016/j.cell.2020.11.0091. Deng, T., Lyon, C.J., Bergin, S., Caligiuri, M.A., and Hsueh, W.A. (2016). Obesity, Inflammation, and Cancer. Annu. Rev. Pathol. 11, 421–449.
2. Beyaz, S., Mana, M.D., Roper, J., Kedrin, D., Saadatpour, A., Hong, S.-J., Bauer Rowe, K.E., Xifaras, M.E., Akkad, A., Arias, E., et al. (2016). High-fat diet enhances stemness and tumorigenicity of intestinal progenitors. Nature 531, 53–58.
3. Li, R., Grimm, S.A., Chrysovergis, K., Kosak, J., Wang, X., Du, Y., Burkholder, A., Janardhan, K., Mav, D., Shah, R., et al. (2014). Obesity, rather than diet, drives epigenomic alterations in colonic epithelium resembling cancer progression. Cell Metab. 19, 702–711.
4. Pavlova, N.N., and Thompson, C.B. (2016). The Emerging Hallmarks of Cancer Metabolism. Cell Metab. 23, 27–47.
5. Chang, C.H., Qiu, J., O’Sullivan, D., Buck, M.D., Noguchi, T., Curtis, J.D., Chen, Q., Gindin, M., Gubin, M.M., van der Windt, G.J.W., et al. (2015). Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell 162, 1229–1241.