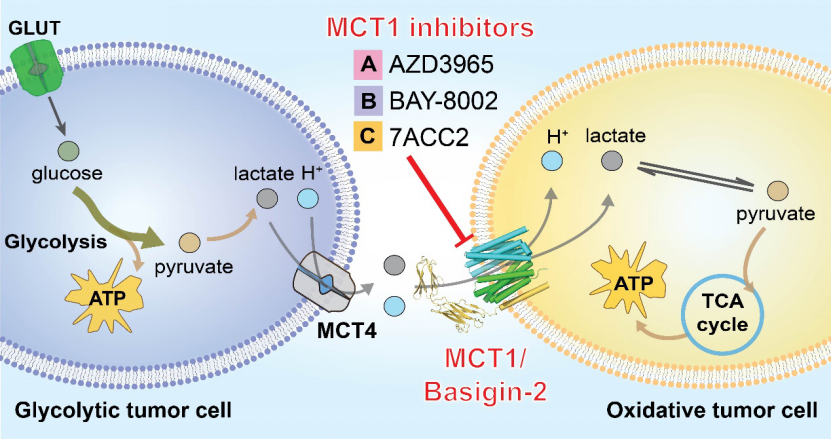
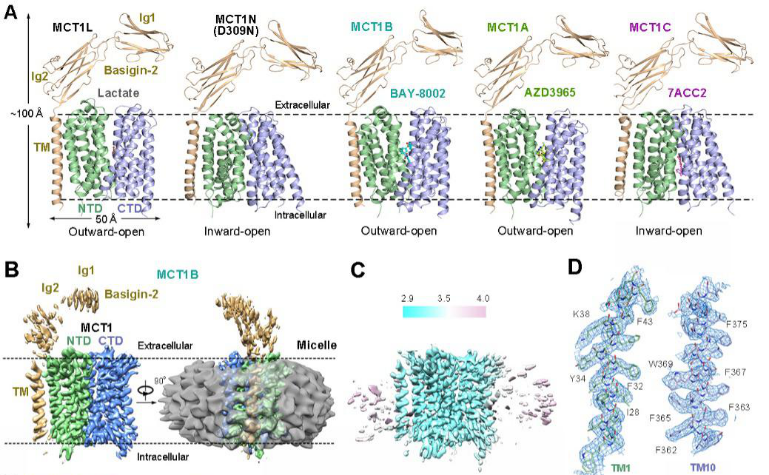
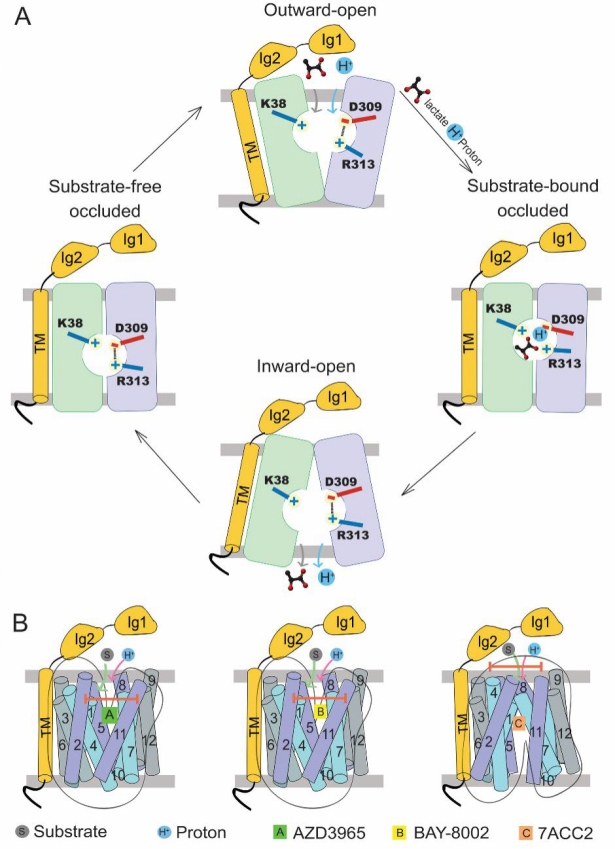
以乳酸、丙酮酸和酮体为代表的单羧酸是大多数哺乳动物细胞中必需的代谢产物。这些单羧酸代谢物的动态吸收和再分配是由单羧酸转运蛋白(monocarboxylate transporter, MCT)完成的。人体内的单羧酸转运蛋白有两种类型:质子偶联的单羧酸转运蛋白(MCTs)和钠离子偶联的单羧酸转运蛋白(SMCTs)。MCTs属于溶质转运蛋白家族16(SLC16)或MFS超家族。在14种已鉴定的MCT中,MCT1-MCT4在多种组织中表达,催化一元羧酸的质子偶联双向转运。而MCT1是最早被发现且广泛分布在各组织细胞中、维持细胞基本稳态的重要亚型。MCT1-4的膜定位需要糖基化分子伴侣蛋白,如协助MCT1、3和4定位的分子伴侣Basigin(也称为CD147或EMMPRIN)和协助MCT2定位的分子伴侣Embigin(或gp-70)。在生理条件下,MCT1-4协同糖酵解型细胞和氧化型细胞之间的乳酸穿梭,这是不同组织中乳酸稳态的关键过程。该过程对于肌细胞和神经细胞的能量代谢具有重要作用,如运动过程中白肌细胞产生的乳酸会被氧化型的红肌细胞吸收,以糖酵解为主的神经胶质细胞产生的乳酸会被氧化型为主的神经元吸收。因此MCT1的异常表达或者功能失活会导致多种人类疾病,包括乳酸转运缺陷症(SDLT)、家族性高胰岛素性低血糖(HHF7)和单羧酸转运蛋白1缺乏症(MCT1D)。同时MCTs的表达改变也与神经退行性疾病、癫痫、脑缺血等多种脑疾病密切相关。更重要的是,MCT1、2和4在多种癌症中的高表达与癌症的发展有密切关系。由MCT1和其他亚型共同介导的乳酸穿梭能够连接以糖酵解为主要产能方式(Glycolytic tumor cell)和以线粒体氧化为主要产能方式(Oxidative tumor cell)的癌细胞使其形成协同代谢,从而促进肿瘤的发生与发展(图1)。图1 MCT1-4介导的糖酵解型和氧化型肿瘤细胞之间的乳酸穿梭由于其在癌症发生中的重要作用,MCT1被认为是重要的癌症治疗靶点。多个早期研究已指出抑制MCT1活性能够有效减缓癌细胞的生长和增殖。同时多个以MCT1为靶点的小分子抑制剂也被报道。其中,以正在进行针对癌症一期临床实验的AZD3965分子最为引人注目。然而,由于缺乏结构信息,MCT1的转运机理和小分子抑制剂的抑制机制一直未被阐明。2020年12月16日,清华大学研究员闫创业课题组和澳大利亚新南威尔士大学研究员蒋鑫课题组合作在Cell上发表了文章Structural basis of human monocarboxylate transporter 1 inhibition by anti-cancer drug candidates,揭示了候选抗癌药物对人源单羧酸转运蛋白抑制机理(图2)。图2 MCT1/Basigin-2复合物与天然底物及三种经典小分子抑制剂在不同构象下的结构该论文报道了MCT1和其伴侣蛋白Basigin-2在结合天然底物乳酸和不同小分子底物抑制剂的单颗粒冷冻电镜结构。通过对比外向开口构象(Outward-facing conformation)的野生型MCT1结构和模拟持续质子化的D309N突变体的内向开口构象(Inward-facing conformation)结构,研究人员阐明了MCT1的底物识别、质子偶联转运和交替开放的机理(图3A)。更进一步,文章通过解析MCT1/Basigin-2蛋白复合体与三个代表性小分子抑制剂AZD3965、BAY-8002和7ACC2的结构在近原子水平上阐明了不同构象下小分子抑制剂与MCT1蛋白的结合模式。(图3B)。图3 单羧酸转运蛋白MCT1的转运机制和小分子抑制剂的抑制机理作为一期临床实验中的先导化合物,AZD3965代表了最有希望成为抗癌药物的MCT1抑制剂。然而,由于AZD3965对于MCT1的选择性抑制,其对于MCT1和MCT4高表达的癌细胞杀伤效果欠佳。为了给进一步药物优化提供信息,研究人员根据MCT1/Basigin-2与AZD3965结合的复合物结构信息设计了一系列的突变体,通过生化功能实验阐明了AZD3965对MCT亚型的选择性机理。由此,该工作通过结构生物学和生物化学相结合的手段阐明MCT1的转运机理和小分子抗癌候选药物的抑制机制,为进一步靶向MCTs的药物发现奠定了基础。值得一提的是,MCT1/Basigin-2复合物没有对称性且分子量只有大约80kDa,并且胞外区域比较柔性,只有50kDa的穿膜区比较稳定,这对冷冻电镜的结构解析形成了巨大挑战。为了解决这些技术难题,研究人员设计了一种“降噪-再加权”(Noise reduction and re-weighting methods)的新型数据处理方法,结合之前开发的“引导性多参照三维分类”(Guided multi-reference 3D classification)方法,以及新的优选颗粒辅助三维分类方法(Seed-facilitated 3D classification)有效地消除了蛋白外的噪音信号,进一步突破了冷冻电镜解析非对称性膜蛋白样品的分子量下限,分辨率达到3 Å(图2C、D)。这一方法将为进一步研究低分子量、非对称性膜蛋白提供新的思路。 文章的共同通讯作者为清华大学生命科学学院研究员闫创业和澳大利亚新南威尔士大学研究员蒋鑫;清华大学生命科学学院2016级博士生王楠和新南威尔士大学研究员蒋鑫为本文的共同第一作者;清华大学生命学院2017级博士生张硕和2019级博士生朱盎岐参与了数据收集和生化实验;清华大学生命学院博士后袁亚飞、技术员徐翰文对本研究提供了帮助;清华大学冷冻电镜平台主管雷建林博士为冷冻电镜数据收集提供了帮助。实验的电镜数据采集受到清华大学冷冻电镜平台和西湖大学冷冻电镜平台的支持,实验的计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)的支持。
https://doi.org/10.1016/j.cell.2020.11.043