肺动脉高压(PAH)是一种由于肺血管重构和进行性狭窄导致肺动脉阻力持续增高的恶性心血管疾病,病理机制复杂不清。据北京协和医院心内科荆志成教授课题组报道,BMPR2 是中国PAH患者最主要的致病基因【1】;中国人群中,携带BMPR2 基因突变的患者发病更早,临床表型更差,死亡风险更高【2】。然而,BMPR2 基因突变外显率仅为20%;在同一家族内携带同样BMPR2 基因突变的亲属表型差别迥然【3, 4】。因此基因序列变异以外的遗传因素即表观遗传很可能在PAH中发挥重要的作用。DNA甲基化是表观遗传学的标志之一,是指DNA甲基转移酶(DNMTs)将一个甲基从供体S-腺苷甲硫氨酸转移到胞嘧啶的5’-碳分子上,形成5’-甲基化胞嘧啶的DNA修饰过程【5】。哺乳动物的DNA甲基化修饰绝大多数都发生在与鸟嘌呤相连的胞嘧啶上(通常表示为CpG)。人类基因组所有的CpG中约有70%被甲基化,未被甲基化的CpG成簇聚集,形成CpG岛。DNA甲基化与基因转录密切相关,CpG岛低甲基化可致基因表达水平上调【6】,而超甲基化则可致基因表达沉默或表达水平降低【7】。DNA甲基化是建立和维持其他表观遗传机制的基础,在调控染色质结构和基因表达中发挥重要作用【8】。围绕表观遗传调控荆志成教授团队率先进行了前瞻性探索,发现相对于携带BMPR2突变不发病的对照人群,该基因突变的患者BMPR2基因启动子区甲基化程度显著升高,首次证实DNA甲基化是影响BMPR2基因突变外显的重要因素【9】。该项研究结果于2017年发表在呼吸领域顶级杂志American Journal of Respiratory and Critical Care Medicine上,为解析PAH的表观遗传调控机制提供了重要线索。近日,荆志成教授团队在Science Advances发表了题为DNA Methyltransferase 3B Deficiency Unveils A New Pathological Mechanism of Pulmonary Hypertension的研究长文,揭示了DNA甲基化转移酶3B(DNMT3B)调控肺动脉高压血管重构进程的作用与机制,提出上调DNMT3B可改善PAH的新概念,同时也指出DNMT3B有望成为治疗肺动脉高压的新颖靶点。

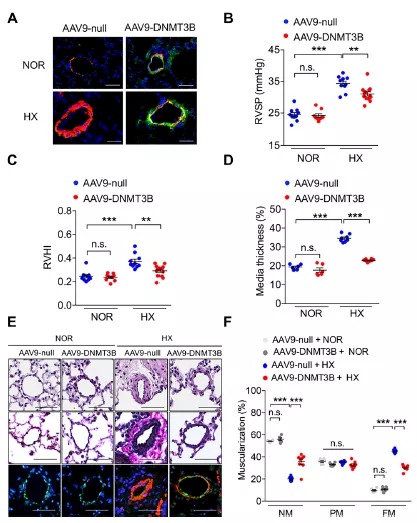
迄今为止,DNA甲基化在PAH的研究甚少。据报道,在自发性肺高压大鼠模型的肺组织和PAH患者的肺组织中,超氧化物歧化酶-2(SOD2)的CpG岛甲基化上升,表达显著降低;体外实验证实SOD2的高甲基化增加肺动脉平滑肌细胞(PASMCs)增殖,抑制凋亡,从而促进PAH表型【01】。此外,在持续性PAH新生羔羊胎儿的肺动脉内皮细胞(PAECs)中,内皮型一氧化氮合成酶(eNOS)启动子区DNA甲基化增加【11】。近年来,研究学者发现肺高血压患者的PAECs【12】DNA甲基化特征较对照细胞明显不同。综上所述,这些研究探索了在PAH发展中受DNA甲基化调节的某些特定基因,但缺乏对DNA甲基化全貌的认知。除此之外,DNA甲基转移酶的甲基化调控具有组织特异性,PAH肺组织的总体DNA甲基化水平如何改变?DNMTs的表达是否改变?这种改变对PAH的进程有何影响?DNMTs是否可成为新的PAH治疗靶点?这一系列问题都悬而未决。据悉,该研究团队通过构建野百合碱(MCT)和低压低氧诱导的两种肺高压大鼠模型,检测肺组织总体DNA甲基化水平及DNMTs家族蛋白的表达改变,首次证明了在MCT或低压缺氧暴露后,PAH大鼠模型的肺组织总体DNA甲基化水平显著升高。DNMT3B被证实为两种PAH模型大鼠肺组织中唯一表达上调的DNMT。免疫组化结果显示PAH患者肺组织中DNMT3B阳性细胞数较对照组显著增加。且PAH患者来源的PASMCs较对照组的DNMT3B转录水平亦显著增加。为了阐明DNMT3B在PAH发生发展中的作用,该团队构建DNMT3B基因敲除大鼠,并予以MCT或低压低氧病理诱导。研究表明,在病理诱导条件下,DNMT3B基因缺陷大鼠表现出较野生型对照更为严重的血流动力学损害、右心肥厚及肺血管病理性重构。基于体内水平提示DNMT3B的缺失会加重肺血管病理性重构作用,研究者进一步通过体外实验证实DNMT3B的抑制或敲低促进血小板源性生长因子(PDGF)-BB诱导的人源和鼠源PASMCs增殖及迁移,从而加重肺血管重构。为了明确DNMT3B上调后能否逆转PAH恶性表型,研究者构建包装人源性DNMT3B基因的腺相关病毒(AAV9-DNMT3B),采用气道投递方式感染C57BL/6小鼠,予以低氧诱导,AAV9-DNMT3B感染组较对照组血流动力学及肺血管重构明显改善,右心肥厚指数下降(图1)。体外实验亦证实过表达DNMT3B能够逆转PDGF-BB诱导的PASMCs增殖/迁移,从而改善血管重构。图1. DNMT3B过表达改善血流动力学、肺血管重构及右心肥厚以上结果提示DNMT3B在肺血管重构过程中起到保护作用,那么DNMT3B是如何调控肺血管重构呢?接下来,该团队利用RNA-seq高通量方法检测DNMT3B高表达后人源PASMCs的转录组改变,研究发现DNMT3B高表达可下调包括自然杀伤细胞介导的细胞毒性、肿瘤坏死因子信号通路等多种炎症通路。此外,在MCT诱导和低压低氧诱导下,DNMT3B基因缺陷大鼠较野生对照组肺组织中趋化因子CCL5转录水平明显上调。进一步提示DNMT3B可通过炎症介质或通路调控肺血管重构。总而言之,该研究首次将DNMT3B表观遗传调控与肺血管重构结合在一起,全面考察和探讨了DNMT3B改善PAH肺血管重构的作用及机制,证实了DNMT3B是PAH发病机理中的新型调节介质,并有望成为治疗PAH的潜在靶点。同济大学附属上海市肺科医院颜艺博士(现于慕尼黑大学从事博士后研究)、中国医学科学院心血管疾病国家重点实验室何阳阳博士后(现为河南大学药学院副教授)、北京协和医院蒋鑫副主任医师为该论文共同第一作者,北京协和医院荆志成教授为通讯作者。
https://advances.sciencemag.org/content/6/50/eaba2470
1. Liu, D., et al., Molecular genetics and clinical features of Chinese idiopathic and heritable pulmonary arterial hypertension patients. Eur Respir J, 2012. 39(3): p. 597-603.
2.Liu, D., et al., BMPR2 mutations influence phenotype more obviously in male patients with pulmonary arterial hypertension. Circ Cardiovasc Genet, 2012. 5(5): p. 511-8.
3.Sztrymf, B., et al., Genes and pulmonary arterial hypertension. Respiration, 2007. 74(2): p. 123-32.
4.Larkin, E.K., et al., Longitudinal analysis casts doubt on the presence of genetic anticipation in heritable pulmonary arterial hypertension. Am J Respir Crit Care Med, 2012. 186(9): p. 892-6.
5.Bird, A.P., CpG-rich islands and the function of DNA methylation. Nature, 1986. 321(6067): p. 209-13.
6.Klose, R.J. and A.P. Bird, Genomic DNA methylation: the mark and its mediators. Trends Biochem Sci, 2006. 31(2): p. 89-97.
7.Ball, M.P., et al., Targeted and genome-scale strategies reveal gene-body methylation signatures in human cells. Nat Biotechnol, 2009. 27(4): p. 361-8.
8.Suzuki, H., et al., A genomic screen for genes upregulated by demethylation and histone deacetylase inhibition in human colorectal cancer. Nat Genet, 2002. 31(2): p. 141-9.
9.Liu, D., et al., Hypermethylation of BMPR2 Promoter Occurs in Patients with Heritable Pulmonary Arterial Hypertension and Inhibits BMPR2 Expression. Am J Respir Crit Care Med, 2017. 196(7): p. 925-928.
10.Archer, S.L., et al., Epigenetic attenuation of mitochondrial superoxide dismutase 2 in pulmonary arterial hypertension: a basis for excessive cell proliferation and a new therapeutic target. Circulation, 2010. 121(24): p. 2661-71.
11.Ke, X., et al., Persistent pulmonary hypertension alters the epigenetic characteristics of endothelial nitric oxide synthase gene in pulmonary artery endothelial cells in a fetal lamb model. Physiol Genomics, 2018. 50(10): p. 828-836.
12.Hautefort, A., et al., Pulmonary endothelial cell DNA methylation signature in pulmonary arterial hypertension. Oncotarget, 2017. 8(32): p. 52995-53016.