01
Cell:重大进展!包括新冠病毒在内的β冠状病毒利用溶酶体劫持和离开受感染细胞
doi:10.1016/j.cell.2020.10.039
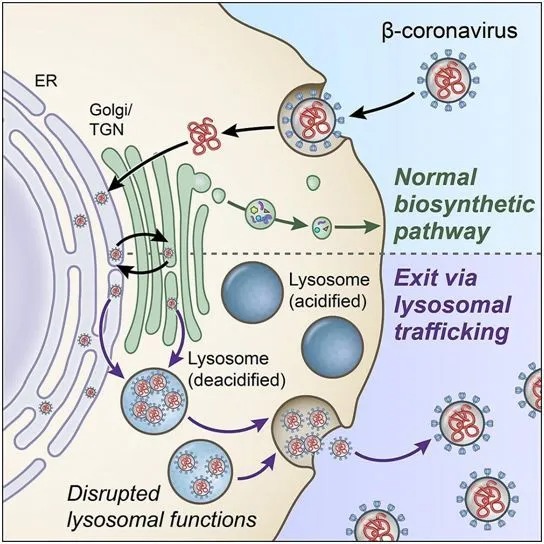
在一项新的研究中,来自美国国家卫生研究院(NIH)的研究人员发现了一种生物途径,当包括SARS-CoV-2在内的β冠状病毒在体内传播时,它们似乎可以利用这种生物途径劫持和离开细胞。更好地了解这一重要途径可能会在阻止这种导致COVID-19疾病的SARS-CoV-2冠状病毒的传播方面提供了重要的新见解。相关研究结果于2020年10月27日在线发表在Cell期刊上,论文标题为“β-Coronaviruses use lysosomes for egress instead of the biosynthetic secretory pathway”。
在细胞研究中,这些作者首次发现,β冠状病毒可以通过溶酶体---一种称为细胞“垃圾粉碎机(trash compactor)”的细胞器---离开受感染的细胞。通常情况下,溶酶体会在病毒和其他病原体离开细胞之前将它们摧毁。然而,这些作者发现,β冠状病毒会使得溶酶体的抗病机制失活,从而允许它在体内自由传播。靶向这种溶酶体途径有可能导致人们开发新的、更有效的抗病毒疗法来对抗COVID-19。
02 Cell:通过CRISPR筛选鉴定出抵抗新冠病毒感染的基因和药物靶标 在一项新的研究中,为了确定SARS-CoV-2的新的潜在治疗靶点,来自美国纽约大学、纽约基因组中心和西奈山伊坎医学院等研究机构的研究人员进行了全基因组范围内的功能缺失CRISPR筛选,以便系统地敲除人类基因组中的基因。他们研究了哪些基因修饰使得人肺细胞对SARS-CoV-2感染更具抵抗力。他们的研究结果揭示了人类基因组中的哪些基因和基因调控网络是SARS-CoV-2感染所需的,抑制这些基因赋予了对这种冠状病毒感染的抵抗力。他们描述了一系列以前没有被认为是SARS-CoV-2治疗靶点的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Identification of required host factors for SARS-CoV-2 infection in human cells”。 为了更好地理解宿主和病毒遗传依赖性之间的复杂关系,这些作者使用了一系列分析和实验方法来验证他们的结果。这种综合方法包括基因组编辑、单细胞测序、共聚焦成像以及基因表达和蛋白质组数据集的计算分析。他们发现,这些新的基因靶点在使用小分子(药物)加以抑制后,可显著降低病毒载量,其中的有些药物降低病毒载量高达1000倍。他们的研究结果为可能开发有效治疗COVID-19的新型药物提供了重要见解,并揭示它们的分子靶点。 03 Cell:全基因组CRISPR筛选鉴定出对新冠病毒感染至关重要的宿主因子 在一项新的研究中,来自美国耶鲁大学和布罗德研究所等研究机构的研究人员对暴露于SARS-CoV-2和MERS-CoV冠状病毒的数亿个细胞进行了筛选,鉴定出几十个能使这两种病毒在细胞中复制的基因,也鉴定出一些似乎抑制这些病毒的基因。他们表示,这些基因的促病毒作用和抗病毒作用将有助于指导科学家们开发新的疗法来对抗COVID-19。相关研究结果近期发表在Cell期刊上,论文标题为“Genome-wide CRISPR screens reveal host factors critical for SARS-CoV-2 infection”。 在这项新的研究中,这些研究人员对绿猴细胞进行了全基因组CRISPR筛选,其中与常用的人类细胞系相比,绿猴细胞在暴露于SARS-CoV-2后更容易死亡。这种筛选首次允许他们同时跟踪病毒和细胞之间的相互作用。这种筛选证实了早先的发现,即编码细胞表面受体的ACE-2基因能促进SARS-CoV-2感染宿主细胞。 然而,这种筛选还发现了两种新的促病毒蛋白复合物和第三种似乎有助于阻止感染的蛋白复合物。他们发现,能开启和关闭基因的SWI/SNF复合物和具有包括调节炎症在内的许多功能的HMGB1与感染后细胞死亡增加有关。 这些研究人员随后加入了抑制已发现的这两种基因产物功能的小分子药物,并发现它们可以增加培养皿中的细胞在感染后的存活率。相比之下,有助于调节细胞核内基因表达的组蛋白H3复合物似乎提供了一种保护作用,这会抑制SARS-CoV-2感染和杀死细胞的能力。 04 Cell解读!科学家们真能利用CRISPR/Cas9技术来纠正人类胚胎中的突变?或许为时尚早! 近日,一篇刊登在国际杂志Cell上题为“Allele-Specific Chromosome Removal after Cas9 Cleavage in Human Embryos”的研究报告中,来自哥伦比亚大学等机构的科学家们通过研究描述了CRISPR基因编辑技术对人类胚胎中基因进行编辑后所出现的意想不到的不良结果。 对人类胚胎中致病基因突变的修正或许有望减少人类遗传性疾病的负担,并能改善携带致病性突变夫妇的生育疗法(以此能代替对胚胎的选择),这项研究中,研究人员评估了在父源性染色体EYS位点上引入Cas9诱导的双链断裂(DSB)所产生的修复结果,EYS位点携带有一种会诱发失明的移码突变(frameshift mutation),研究者发现,最常见的修复结局都是微同源性介导的末端连接,而该过程发生在胚胎发育的第一个细胞周期中,其会导致胚胎出现读码阅读框的非镶嵌型修复,而值得注意的是,大约一半的断裂并不会被修复,从而就会产生未检测到的父源性等位基因的出现,且会在优势分裂后失去一条或两条染色体臂。相应地,Cas9脱靶的断裂则会导致染色体丢失及半合子不整合的出现(因为两个等位基因发生了断裂),相关研究结果揭示了科学家操控染色体内容物的能力,同时也提出了修正人类胚胎中突变所面临的重大挑战。 2015年科学家们首次报道了CRISPR技术在人类胚胎中的使用情况,而就在随后的2018年,贺建奎声称在中国的一对双胞胎中进行了CRISPR技术的应用,随机引起了全球科学家和政府官员的强烈谴责。这项研究中,研究者Egli及其同事分析了CRISPR/Cas9基因编辑技术对携带EYS((eyes shut homolog))基因突变的早期人类胚胎所产生的影响效应,该基因会引发遗传性失明。研究者说道,此前我们对分化的人类细胞和小鼠进行研究发现,DNA的断裂往往会产生两种结局,即精确修复或微小的局部改变;在EYS基因中,这些改变会产生一种功能性基因,尽管其并不算是一种完美的修复。 05 Cell:百年谜团终破解!细胞中的镁离子激活剂竟是乳酸 在一项新的研究中,来自美国德克萨斯大学健康科学中心的研究人员解开了一个存在了100年之久的谜团:是什么激活了细胞中的镁离子。这一发现有望成为未来开发治疗心血管疾病、糖尿病等代谢性疾病的新型药物的跳板。相关研究结果近期发表在Cell期刊上,论文标题为“Lactate Elicits ER-Mitochondrial Mg2+ Dynamics to Integrate Cellular Metabolism”。 这些研究人员说,细胞中镁离子的激活剂是一种称为乳酸的代谢物。在剧烈运动时和在包括心脏病、糖尿病、败血症和癌症在内的许多疾病中,血液中的乳酸会升高。 论文通讯作者、德克萨斯大学健康科学中心心脏病学教授Madesh Muniswamy博士说,“就像灯的开关一样,乳酸是一种激活镁离子的信号。在乳酸信号存在下,镁离子从称为内质网的细胞器中冲出。” 06 Cell:利用体内产生的内源性大麻素对抗肠道感染 在一项新的研究中,来自美国得克萨斯大学西南医学中心的研究人员发现作为体内产生的与大麻中的化学物有共同特点的信号分子,内源性大麻素(endocannabinoid)可以关闭一些致病性肠道细菌定植、增殖和致病所需的基因。相关研究结果近期发表在Cell期刊上,论文标题为“Endocannabinoids Inhibit the Induction of Virulence in Enteric Pathogens”。 论文通信作者、得克萨斯大学西南医学中心微生物学与生物化学教授Vanessa Sperandio博士说,内源性大麻素是否会影响对致病性胃肠道感染的敏感性一直是未知数。 Sperandio和她的同事们研究了经过基因修饰后在包括肠道在内的各种器官中过量产生强效的哺乳动物内源性大麻素2-花生四烯酰甘油(2-arachidonoyl glycerol, 2-AG)的小鼠。当用一种攻击结肠并引起明显炎症和腹泻的称为柠檬酸杆菌(Citrobacter rodentium)的细菌病原体感染这些经过基因修饰小鼠(下称突变小鼠)和它们的未经过基因修饰的同窝出生小鼠(下称野生小鼠)时,与野生小鼠表现出的更极端的胃肠不适相比,突变小鼠只出现了轻微症状。对突变小鼠结肠的检查显示,炎症和感染的迹象要低得多。相比于野生小鼠,这些突变小鼠的粪便中柠檬酸杆菌的含量也显著降低,而且它们更早地清除了这种细菌感染。用一种能提高肠道中2-AG水平的药物治疗野生小鼠,也产生了类似的积极效果。 Sperandio团队发现,提高2-AG的水平还可以减弱小鼠中的鼠伤寒沙门氏菌感染,并阻碍肠出血性大肠杆菌--一种感染人类的特别危险的胃肠道细菌--表达成功感染所需的毒力特征。相反,当这些研究人员用四氢利普司他汀(tetrahydrolipstatin)处理培养皿中的哺乳动物细胞时,它们变得更容易受到细菌病原体的影响。四氢利普司他汀是一种经美国食品药物管理局(FDA)批准的化合物,以商品名Alli的名义在市场上销售。 07 Cell:我国科学家揭示努南综合征和多发性雀斑努南综合征的发病机制 努南综合征(Noonan syndrome, NS)和多发性雀斑努南综合征(Noonan syndrome with multiple lentigines, NS-ML)是由蛋白SHP2突变引起的罕见人类发育障碍。在此之前,NS和NS-ML的发病机制一直不清楚,也没有任何有效的方法来治疗这些疾病。 如今,在一项新的研究中,来中国科学院上海有机化学研究所等研究机构的研究人员发现了NS和NS-ML的发病机制。他们发现疾病相关的SHP2突变体获得了液-液相分离(liquid-liquid phase separation, LLPS)的能力以提高酶的活性,从而导致下游细胞信号通路的过度激活。相关研究结果近期发表在Cell期刊上,论文标题为“Phase Separation of Disease-Associated SHP2 Mutants Underlies MAPK Hyperactivation”。论文通讯作者为中国科学院上海有机化学研究所的Cong Liu和Jidong Zhu。 08 Cell:破解一个存在已久的医学之谜!克罗恩病患者中的脂肪爬行竟与一种肠道细菌有关 炎症性肠病(IBD)是一种累及回肠、直肠和结肠的特发性肠道炎症性疾病,它的临床表现为腹泻、腹痛,甚至可有血便。IBD包括溃疡性结肠炎(UC)和克罗恩病(CD)。许多克罗恩病(Crohn's disease)患者的腹部脂肪迁移到发炎的小肠壁上。是什么促使脂肪组织“爬行(creep)”穿过腹部并包裹住许多患上这种炎症性肠病(IBD)的患者的肠道,一直是一个持久的谜。 如今,在一项新的研究中,来自美国西达赛奈医疗中心的研究人员发现了一条关键线索。他们证实脂肪组织的这种特殊爬行最初似乎是保护性的,但最终却弊大于利。相关研究结果近期发表在Cell期刊上,论文标题为“Translocation of Viable Gut Microbiota to Mesenteric Adipose Drives Formation of Creeping Fat in Humans”。 论文通讯作者Suzanne Devkota博士说,“脂肪爬行通常是外科医生对IBD患者的肠道进行切除的一种标志性特征,这是因为当他们看到它时,他们知道这很可能是病变的位置。然而,我们并不知道脂肪的存在是让这种疾病恶化,还是试图保护肠道免受某些东西的影响。” 09 Cell:给剖腹产婴儿进行母亲粪便菌群移植可能有助于建立健康的肠道微生物群 剖腹产的婴儿在婴幼儿时期患哮喘和过敏症的风险增加,这可能是因为他们在出生时没有接触到母亲阴道和会阴部的微生物群,这对他们的免疫系统发育产生了负面影响。已有一些研究探讨了在新生儿出生后立即用阴道液擦拭他们的皮肤是否能降低这种风险。不过,在一项新的研究中,来自芬兰赫尔辛基大学的研究人员提供了一种更激烈的方法,让新生儿接触到他们母亲的微生物群:将母亲的少量粪便稀释在母乳中,并在他们刚出生时就喂给他们。他们报告说,这种概念验证的方法似乎是安全的,在出生三个月时,新生儿的微生物组成看起来比剖腹产的婴儿更类似于阴道分娩的婴儿。相关研究结果于2020年10月1日在线发表在Cell期刊上,论文标题为“Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study”。 论文共同作者、赫尔辛基大学儿科研究中心的Sture Andersson说,“从临床的角度来看,这种微生物物质的转移是在阴道分娩过程中发生的。这是母亲送给她的婴儿的礼物。” 10 Cell:“国际肿瘤新抗原选择联盟”解锁新型个体化癌症疗法 通过改善肿瘤新抗原的预测揭示肿瘤表位免疫原性的关键参数 新抗原(neoantigens,肿瘤抗原),一种源于癌症突变的微小标志物,其能标志细胞癌变的开始,或有望成为科学家们开发新一代免疫疗法的关键;在癌症疫苗和细胞疗法的开发过程中,靶向作用“正确”的新抗原或有望以最小的副作用消除患者机体的癌症,但在肿瘤中存在数百种突变,而且仅有少数会产生诱发机体抵御癌症的免疫反应的新抗原,那么到底是哪些癌症突变会产生这些新抗原呢? 近日,一项刊登在国际杂志Cell上的研究报告中,来自帕克癌症免疫治疗研究所等机构的科学家们通过研究发现了一些特殊的参数,其或能帮助预测哪些新抗原能够更好地刺激机体的抗癌效果,相关研究结果或有望帮助开发新一代高效的个体性化癌症免疫疗法。通过进行先进的计算机分析,研究人员发现了5个特征或许能强烈指示哪些癌症标志物最有可能会刺激机体产生免疫反应,其主要分为两类,即新抗原在癌细胞表面呈现的方式以及这些新抗原如何被免疫系统所识别。 当研究人员将强调这5个特征的数据模型与另一组癌症样本进行对比测试时,他们发现,这些特征能够准确预测75%的有效新抗原靶点,并能过滤98%的无效靶标;研究者Daniel Wells说道,我们的目标是当开发一种基于新抗原的疗法时,使得来自肿瘤新抗原选择联盟(TESLA,Tumor Neoantigen Selection Alliance)的数据成为参考标准,如果每一种方法(无论新旧)都使用这些数据来作为其进行预测的基准,那么整个研究领域的研究人员就能够进行合作并开发出更多新方法。
doi:10.1016/j.cell.2020.10.030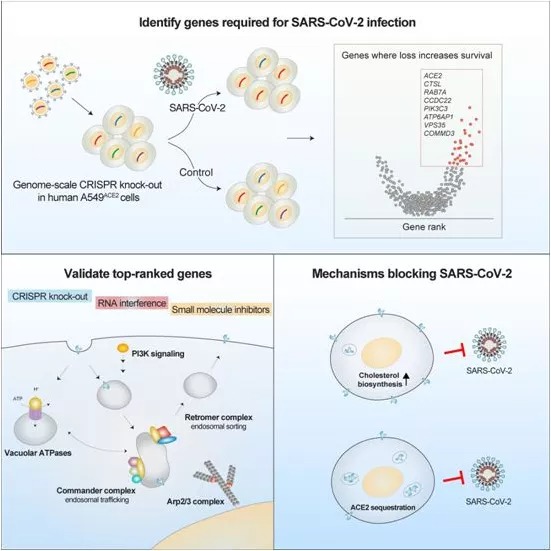
doi:10.1016/j.cell.2020.10.028
doi:10.1016/j.cell.2020.10.025
doi:10.1016/j.cell.2020.08.049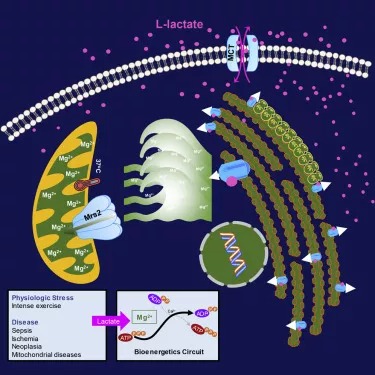
doi:10.1016/j.cell.2020.09.022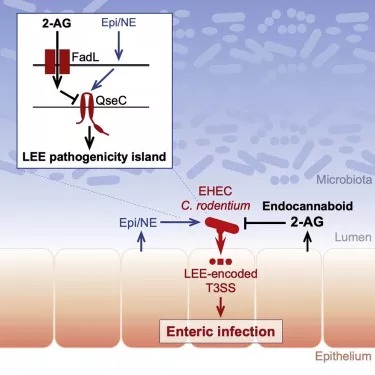
doi:10.1016/j.cell.2020.09.002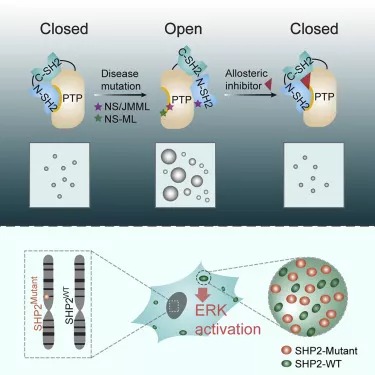
doi:10.1016/j.cell.2020.09.009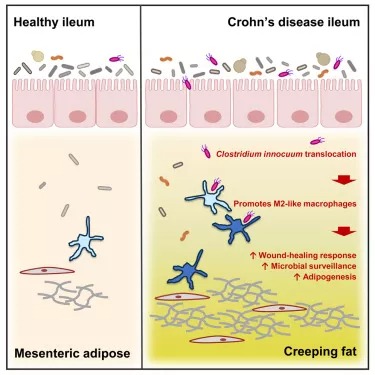
doi:10.1016/j.cell.2020.08.047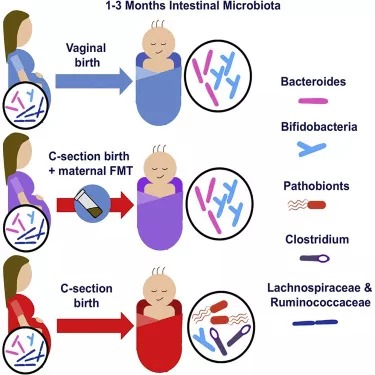
doi:10.1016/j.cell.2020.09.015