2020年11月3日,美国北卡罗来纳大学教堂山分校王刚研究组和加州大学河滨分校宋吉奎合作在 Nature Genetics 杂志在线发表了题为:BAHCC1 binds H3K27me3 via a conserved BAH module to mediate gene silencing and oncogenesis 的研究论文。
该文章揭示了哺乳动物细胞中一个新的H3K27me3“阅读器”是如何调节基因表达并调控癌症生成和生物体发育。这一发现与数十年前在果蝇中进行的一系列经典遗传实验所定义的多梳蛋白(Polycomb)通路密切相关。

多梳蛋白(Polycomb)通路在细胞中的重要基因调控作用一直是个表观遗传学界研究的热点。在细胞中,多梳蛋白会产生一个小的组蛋白修饰H3K27me3,以使基因沉默。与多梳蛋白和H3K27me3相关的分子通常和癌症以及一些发育综合征密切有关。
研究人员对BAHCC1的兴趣最初来自与癌症(尤其是白血病)的联系。白血病是一种影响血液和骨髓的癌症。美国癌症协会估计,今年美国将有超过60000人被诊断出患有白血病,该疾病将导致23000多人死亡。但是对BAHCC1的了解和研究还很少。
研究人员在对公开数据进行回顾性分析后发现,在不同类型的人类急性白血病中,BAHCC1基因都是高表达的。
之后研究人员又通过细胞,生化,生物物理和结构学的方法,发现了人类BAHCC1蛋白内一个保守的BAH结构域(BAHCC1BAH)是动物细胞中一个全新和特异的H3K27me3“阅读器”。
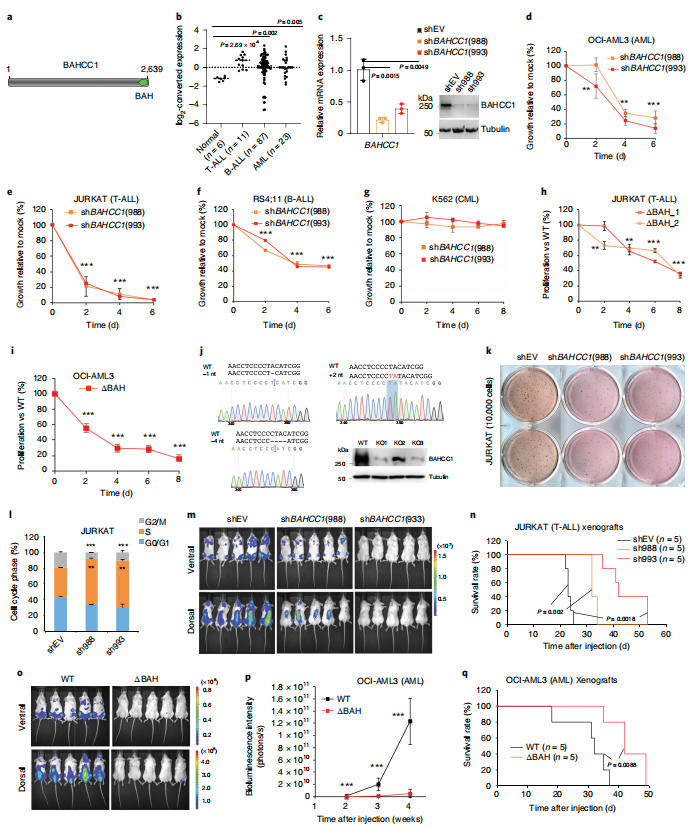
通过基于CRISPR-cas9的基因功能丧失实验表明,疾病发展过程中各种急性白血病对BAHCC1的过表达均有很强的依赖性。染色质免疫沉淀测序(ChIP-seq)和RNA测序(RNA-seq)分析进一步显示,BAHCC1直接识别结合H3K27me3标定的基因,从而实现靶基因最佳的抑制状态。该文章报道了BAHCC1 的BAH结构域(BAHCC1BAH)与H3K27me3复合物的晶体结构。在急性白血病细胞, BAHCC1通过其BAH结构域特异性识别H3K27me3来抑制肿瘤抑制因子,以帮助驱动恶性癌症生成。
研究人员同时利用运用CRISPR/Cas9技术建立了BAHCC1的BAH结构域点突变的动物模型。该模型的试验结果表明,破坏BAHCC1的BAH结构域对H3K27me3识别会导致动物在新生期过早死亡和发育异常,进一步证明了Bahcc1BAH识别H3K27me3在生物体发育中也起着至关重要的作用。
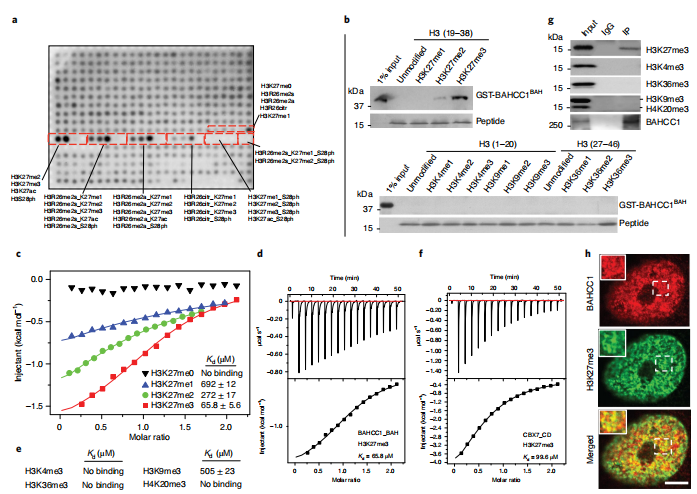
这项研究挑战了当前表观遗传学界倾向于强调已知的CBX蛋白 (CBX2/4/6/7/8) 和PRC1作为H3K27me3的阅读器在Polycomb基因沉默机制中的作用。
结合其他人的最新研究,研究人员认为基于BAH结构域的“阅读器“和相关途径在进化上是古老的,并且在真菌,植物和动物之间是保守的。他们相信这是一条与PRC1一样在进化上古老的机制,并且和PRC1一样保守。在白血病中,BAHCC1被恶性癌细胞选择用来沉默抑癌基因并促进癌变。













