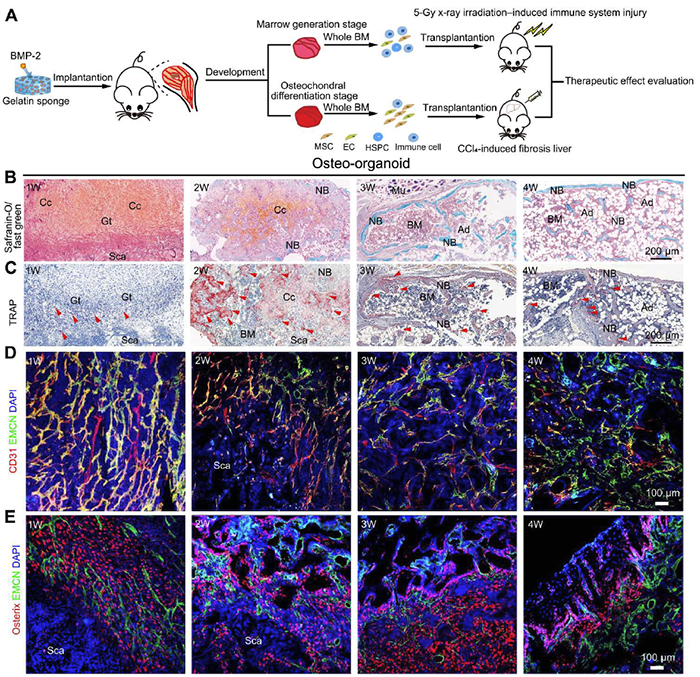
细胞治疗与再生医学的飞速发展对治疗性细胞的稳定足量供应提出更高要求。骨髓组织作为多种干细胞及免疫细胞的“蓄水池”,对机体的稳态维持至关重要,也是治疗性细胞的重要来源。在此背景下,华东理工大学刘昌胜院士和王靖教授课题组基于此前提出的“材料生物学”概念,利用活性生物材料,开发出一种骨形态发生蛋白-2(BMP-2)启动的在体类骨器官(in vivo osteo-organoid)。该在体类骨器官经过仿生发育可形成骨髓样结构,其中包含多种治疗性细胞,如造血干/祖细胞(HSPCs)、间充质干细胞(MSCs)及各型免疫细胞。同时该研究发现在体类骨器官在发育过程中经历组织结构与细胞组成具有明显差异的三个阶段,即纤维增殖期(fibroproliferation;0-1周)、骨软骨分化期(osteochondral differentiation;1-2周)及骨髓形成期(marrow generation;2周之后)。体内动物实验证实处于骨软骨期及骨髓形成期的在体类骨器官来源细胞能够分别治疗CCl4诱导的肝纤维化及X-ray辐照诱导的造血损伤。此研究于2023年1月在Science Advances上发表,题为A BMP-2–triggered in vivo osteo-organoid for cell therapy。在体类骨器官是一种经由负载BMP-2的明胶海绵在体内孵育而成的类骨组织,其在不同发育阶段具有截然不同的组织形态。具体表现为由初期的纤维样结构逐渐发育为成熟的骨髓样结构,并伴随着血管结构与成骨祖细胞数量的改变(图1)。图1. 不同发育阶段在体类骨器官来源细胞的治疗效果评价流程图及组织学评价进一步研究表明在体类骨器官发育至1周及2周时含有最高比例的H型功能血管及MSCs。肝纤维化模型证实,处于骨软骨分化期的在体类骨器官来源细胞能够降低CCL4诱导的肝纤维化水平。研究还发现,在体类骨器官在发育至3周时,其中所含HSPCs数量便趋于稳定,发育至12周时仍能够稳定的产出大量HSPCs。以上表明在体类骨器官不仅能够快速募集HSPCs,同时能够稳定产出HSPCs。X-ray辐照诱导的造血损伤实验证实来源于骨髓形成期的在体类骨器官细胞(12周)仍能够加速造血损伤修复,尤其是淋巴细胞亚群的恢复。研究证实在体类骨器官在不同发育阶段的免疫细胞亚群比例与处于稳态的原位骨髓组织具有诸多不同。具体表现为发育初期含有高比例的T细胞及巨噬细胞,待骨髓形成期则含有高比例的成熟B细胞亚群。在体类骨器官中的免疫细胞组成同样在骨髓形成期(3周)趋于稳定。综上所述,该研究提供了一种基于在体类骨器官的治疗性细胞新来源,能够提供包括HSPCs、MSCs及多种免疫细胞在内的治疗型细胞。同时由于不同发育阶段的在体类骨器官来源细胞具有独特的细胞组成,有望经过进一步开发以用于更多类型的疾病治疗。华东理工大学材料科学与工程学院博士后戴凯是该研究的第一作者,博士后张庆昊为共同一作,通讯作者为华东理工大学王靖教授及刘昌胜院士。
原文链接:
https://www.science.org/doi/10.1126/sciadv.add1541