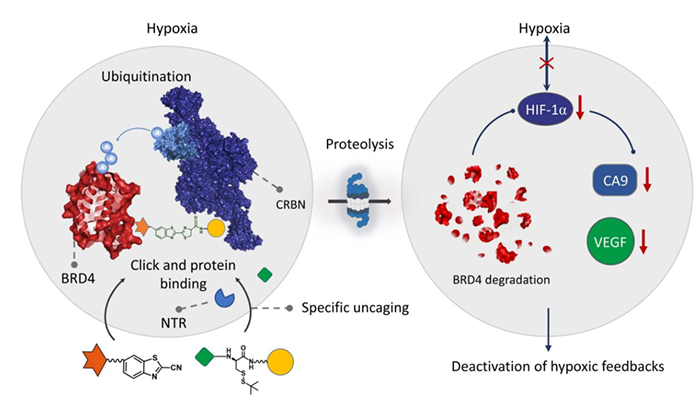
蛋白水解靶向嵌合体(PROTACs)技术是近年来出现的一种利用细胞内泛素-蛋白酶体系统来人工诱导降解细胞内目标蛋白的技术。与传统药物如抗体或小分子抑制剂的“占位驱动” (Occupancy driven) 机制不同,PROTACs技术的“事件驱动” (Event driven) 机制显示出巨大的药理优势,不需要与目标蛋白长时间和高强度的结合以起到抑制蛋白功能,因此可以靶向传统难以成药的蛋白,目前已经成为一种重要的有效肿瘤治疗策略,在药物开发,临床应用中展现出巨大的前景。目前,PROTACs是一种由靶蛋白活性小分子、中间连接体和E3泛素连接酶配体构成的三元复合物。构建此复合物需要多步有机合成以实现分子对接,对分子合成技术有较高要求。此外由于PROTACs分子的复杂结构,其本身具有较大的分子量导致了药物分子较差的水溶性与细胞穿透性。同样,其不良的的药代动力学表现会导致分子在体内的分布缺乏肿瘤特异性,正常组织中的高度富集及潜在的全身性的毒副作用。因此,开发简单,有效的PROTACs策略,并将PROTACs分子靶向递送至肿瘤部位并特异性地降解病变部位目标蛋白仍是药物开发,临床应用等领域中亟待克服的挑战。针对此问题,2022年12月14日,新加坡南洋理工大学邢本刚教授课题组与杜克-新加坡国立大学医学院王小萌副教授合作在Science Advances 在线发表了题为Hypoxia deactivates epigenetic feedbacks via enzyme-derived clicking proteolysis-targeting chimeras的研究文章。该研究首次提出了一种全新的,能够特异性响应乏氧环境中硝基还原酶(NTR)刺激并选择性降解BRD4蛋白的酶响应点击式蛋白水解靶向嵌合体(ENCTACs)技术。此ENCTACs技术实现了两个配体小分子片段基于生物正交反应的可控交联,并在肿瘤乏氧环境下有针对性地消除目标蛋白。这种简单,巧妙的分子片段靶向对接策略促进了乏氧环境中原位的PROTACs药物分子合成,克服了分子从头合成难度大,合成步骤繁琐等不足。避免了传统PROTACs设计中由于分子量大等引起的不良药理性能与毒副作用, 尤其是改善了由于PROTACs分子单向占据蛋白结合位点造成的药物活性下降的Hook effect等缺点。因而展现了更加出色的肿瘤抑制作用。这种创新的ENCTACs策略为未来针对不同疾病的目标蛋白质降解技术的灵活实用性与药物效力的提升提出了有价值的见解。作者首先基于E3泛素连接酶配体pomalidomide分子修饰半胱氨酸和NTR响应基团来设计合成NTR-pomalidomide分子片段,使其在肿瘤乏氧环境下暴露出半胱氨酸基团。随后,半胱氨酸基团与预合成的目标蛋白BRD4配体片段上的2-氰基苯并噻唑(JQ1-CBT)之间发生快速的生物正交点击反应原位生成降解剂分子,进一步诱导特定部位的BRD4蛋白的降解。由此,ENCTACs策略创新性的实现了酶响应的选择性蛋白破坏,并避免了两个蛋白招募剂连接过程中繁琐的化学合成。实验结果表明,随着分子片段底物浓度的增加,多个肿瘤细胞系中的BRD4水平显著降低并伴随着肿瘤细胞的增殖停滞,展现了ENCTACs技术抑制肿瘤细胞生长的可行性。同样ENCTACs诱导的BRD4降解也在乏氧培养的斑马鱼模型和小鼠实体瘤模型中得到验证。通过与预合成的传统BRD4靶向降解剂分子进行对照,ENCTACs技术在细胞层面展示出了优异的乏氧选择性,从而有效避免了组织中的脱靶降解问题,并解决了传统降解剂分子细胞渗透性差的缺陷。图注:ENCTAC在乏氧条件下选择性降解BRD4蛋白值得注意的是,随着环境选择性的ENCTACs介导的BRD4表观遗传蛋白降解,在乏氧的细胞和动物模型中都观察到了HIF-1α表达的显著降低,这表明了BRD4在乏氧介导HIF-1α的转录中起着关键作用。利用ENCTACs策略调节乏氧细胞中BRD4表观遗传蛋白下游的HIF-1α水平,可以进一步有效抑制通路中的CA9信号水平。CA9作为细胞中一种关键的pH调节蛋白,在乏氧环境下会过量表达以快速适应外界环境压力。同时,在细胞层面和斑马鱼血管生成模型的实验中发现,影响血管生成的主要调节因子VEGF的水平也随BRD4的降解产生显著的下降趋势,进一步展现了抑制肿瘤中血管生成的潜在治疗效果。这种由特异性ENCTACs降解引发的CA9和VEGF的联合扰动提供了肿瘤增敏治疗的可能性。此外,这个分子片段靶向对接的ENCTACs技术在生物体内表现出良好的药代动力学特征和抑制肿瘤生长的药物活性,为开发潜在的治疗靶点提供了新的思路。简而言之,该文章提供了一种全新的酶响应的点击式蛋白水解靶向嵌合体(ENCTACs)策略,在乏氧环境特异性诱导的硝基还原酶激活时能够正交连接分别识别BRD4蛋白和E3泛素连接酶的两个不同功能的小分子配体片段。原位生成的双功能降解剂促进BRD4蛋白的特异性下调,进而改变表观遗传下游目标蛋白的表达。ENCTACs在活细胞、斑马鱼和患有实体瘤的小鼠中展现出对乏氧信号的精准调控和治疗功能。这种激活-反馈系统显示出令人信服的优越性,并可能使PROTACs技术在未来具有更灵活的实用性和药物效力,推动该领域潜在的医疗临床研发。南洋理工大学博士研究生Thang Cong Do, 新加坡国立大学博士研究生Jun Wei Law,南洋理工大学博士后孙彩侠,和南洋理工大学博士研究生刘嵩涵为共同第一作者;南洋理工大学邢本刚教授,和杜克-新加坡国立大学医学院王小萌副教授为该论文的共同通讯作者。
原文链接:
http://doi.org/10.1126/sciadv.abq2216