今年张泽民团队与其合作团队在Cell发表的一篇文章将细胞交互运用自如【1】,该研究手段值得借鉴。肿瘤微环境由很多细胞类型组成,每一种细胞类型的异质性,如肿瘤细胞的不同克隆或免疫细胞的不同亚群,进一步增加了肿瘤微环境的复杂性。不同细胞类型的通讯广泛参与肿瘤的发生与发展、免疫浸润、免疫逃逸、炎性等多种生物学机制。该文章构建了细胞-细胞交互网络,定义了调控肿瘤生成与抗肿瘤免疫的关键细胞群体,发现特异的肿瘤相关巨噬细胞与树突状细胞群体是细胞交互网络中的hub节点(网络枢纽,连接不同的细胞群体)。推荐这篇文章的主要原因是其采用了两种方法去层层递进解析细胞交互,并且这两种方法都可以推广到单细胞数据的不同癌症类型、不同的细胞类型间。
一、基于细胞类型signature识别细胞-细胞互作
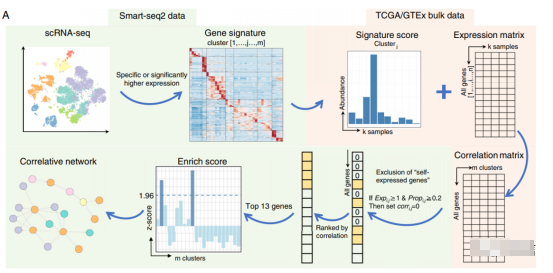
图1:方法流程
1.获取单细胞数据中细胞类型特有的signature:识别细胞类型一般是单细胞数据分析文章中的开胃小菜,这一部分在实践中可以根据自己单细胞数据的测序技术以及测序质量自行参考文章进行分析。
2.基于bulk表达谱推断细胞类型丰度:由于单细胞数据的样本数(指肿瘤块)一般都不是很多,无法支持细胞类型signature之间的一些关联分析,bulk表达谱起到非常好的媒介作用(肿瘤组织bulk表达谱可以从TCGA获得,正常组织的bulk表达谱可以从GTEX获取)。在bulk表达谱中简单地将细胞类型signature基因表达(log转化后标准化的Z-score)的均值作为细胞类型的相对丰度。
3.计算基因表达与细胞类型丰度的相关性矩阵:该方法的假设基础是细胞类型丰度的变化受到细胞-细胞交互的影响,也即细胞类型丰度的变化会受到其他细胞类型基因表达的影响。计算bulk表达谱中每一个基因与细胞类型丰度之间的皮尔森相关性,构建基因表达-细胞类型丰度的相关性矩阵。
4.校正基因表达-细胞类型丰度的相关性矩阵:由于细胞类型signature中的基因很容易与其自身的丰度相关,为了排除细胞类型自身表达基因对后续结果的分析,将“self-expressed gene”(符合以下两个条件:在细胞类型中的平均表达大于1;在细胞类型中表达细胞比例大于20%)的相关性赋值为0。
5.细胞类型富集分析:对于一个给定的细胞类型A,识别哪些细胞类型富集了与细胞类型A丰度高度相关的“nonself-expressed gene”。首先基于单细胞表达谱,计算每一个基因在每种细胞类型中的均值并进行标准化为Z-score,然后从校正的相关性矩阵中选取与细胞类型A丰度相关性排序前13的基因,分别在其他细胞类型中计算这13个基因z-score的均值作为富集得分。
6.构建细胞类型交互网络:若富集得分大于1.96的话则认为细胞类型A与该细胞类型共出现,这两种细胞类型间存在互作。任意一对细胞类型都可以进行上述操作,或者自行选择细胞类型,获得细胞类型-细胞类型间的互作关系对,最终构建细胞-细胞交互网络(图2)。
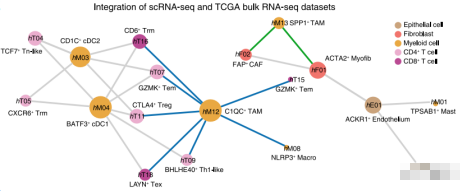
图2:细胞-细胞交互网络
二、基于配体-受体互作解析细胞交互
识别到了细胞类型-细胞类型之间的交互后,进一步解析哪些分子互作介导了细胞交互,配体-受体互作是近年研究细胞通讯的一大利器。
1. 两大配体-受体关系对数据库资源已经解决各位收集配体-受体关系对的苦恼:第一个数据资源其综合了几个配体-受体资源(图3),并对其进行更新、补充以及基于基因互作关系对预测潜在的配体-受体关系对(使用广泛,经常被CNS级别的文章所引用)【2】。(数据下载:其数据资源为该文章的补充材料)
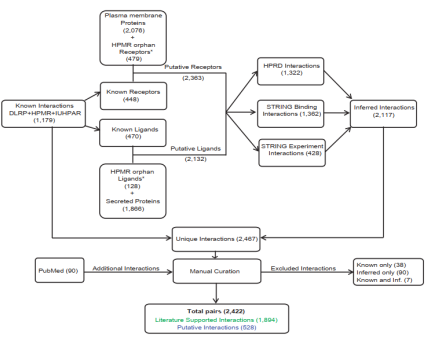
图3:配体-受体的收集过程
第二个配体-受体数据库为CellPhoneDB(https://www.cellphonedb.org/)【3】,其考虑了配体、受体的亚基结构,准确地表示异构体复合物,这个数据库纳入的资源比较齐全,也有一些其他的功能(图4)(感兴趣的小伙伴可以自行了解)
图4:CellPhoneDB的主页面
2. 获得配体-受体关系对之后,首先需要对配体、受体进行细胞类型的表达过滤,在接下来的分析中只考虑在特定细胞类型中表达(log2(TPM+1)>3)细胞比例大于20%的配体、受体,并将未满足条件的配体、受体的表达值赋值为0。(而另一篇Cell的文章并没有考虑表达的过滤【4】,所以小伙伴们可以根据单细胞数据的情况自行把握)
3. 配体、受体在细胞类型间的互作强度(互作得分)被定义为细胞类型A中配体的平均表达与细胞类型B中受体的平均表达的乘积(这个方法也是CNS级别的文章中计算细胞类型间配体-受体互作得分常用的方法)
4. 这篇文章对于配体-受体互作得分的还有一大亮点就是其增加了配体-受体互作得分的显著性,其是基于扰动的思想,对于每一对配体-受体,随机扰动细胞类型标签1000次,按照上述的方法重新计算配体-受体的互作得分,进一步构建互作得分的背景分布,根据真实互作得分获得显著性P值。
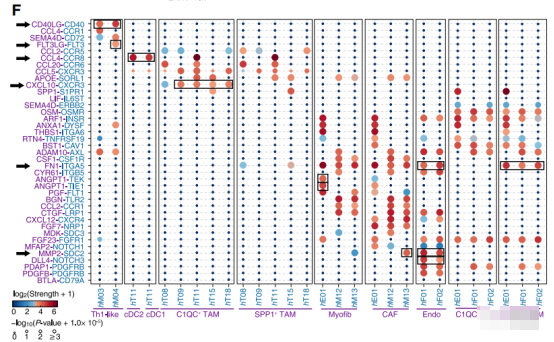
图5:配体-受体互作
例如作者发现CXCL10-CXCR3这对配体-受体显著富集在C1QC+ TAMs中(图5),暗示 C1QC+ TAMs在招募和激活T细胞上的潜在作用(hT08、hT09、hT11、hT15、hT18,是文章识别的不同的T细胞类别,在上述细胞-细胞交互网络中与C1QC+ TAMs存在交互)。
基于细胞类型signature的方法借助了单细胞数据与bulk数据,不仅能够识别肿瘤背景下的细胞交互,同时也能识别正常组织下的细胞交互,对于解析不同细胞类型在肿瘤微环境中扮演的角色提供了新的视角。基于配体-受体的互作为解析细胞交互锦上添花,不仅能够进一步了解细胞交互中的分子机制,而且能够将其分子互作的量化得分与各种肿瘤表型进行关联,更好地解释或者解析不同细胞类型在肿瘤微环境中扮演的角色,有利于新的肿瘤治疗策略的开发。
【1】Single-Cell Analyses Inform Mechanisms of Myeloid Targeted Therapies in Colon Cancer.Cell.2020
【2】A draft network of ligand–receptor-mediated multicellular signalling in human.Nucleic Acids Research.2019
【3】CellPhoneDB: inferring cell–cell communication from combined expression of multi-subunit ligand–receptor complexes.Nat Protoc. 2020
【4】Analysis of Single-Cell RNA-Seq Identifies Cell-Cell Communication Associated with Tumor Characteristics.Cell.2018













