细胞衰老是一种异源性应激反应,表现为细胞周期永久停滞但细胞继续代谢进程。端粒缩短、癌基因表达、表观遗传扰动或抗癌疗法都可能会引发细胞衰老。甲基转移酶——Polycomb Repressive Complex 2 (PRC2) 由EZH2、SUZ12和EED亚基组成,通过组蛋白H3在赖氨酸27残基 (H3K27me3) 上的三甲基化抑制转录,是肿瘤治疗的重要靶点。已有研究发现,EZH2功能获得性突变会驱动肿瘤的发生,MAK683是EED的抑制剂,其抗癌功效已在临床上得到证明,但具体作用机制还有待阐明,这篇最近发表于Cell Death and Disease (IF: 9.69)的文章针对PRC2抑制剂的分子药理机制展开了探索。

PRC2抑制剂MAK683可阻碍癌细胞增殖
研究人员使用PRC2抑制剂(MAK683、EED226以及EPZ26438)处理细胞后发现,这些抑制剂可以在 HeLa细胞中剂量依赖性地降低H3K27me3表达并抑制淋巴瘤细胞(WSU)的增殖(Fig 1b-e)。
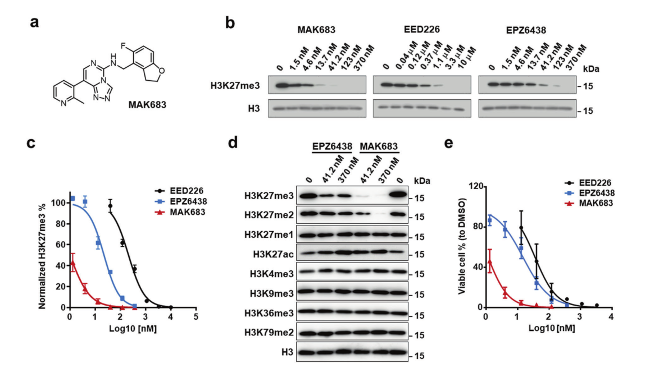
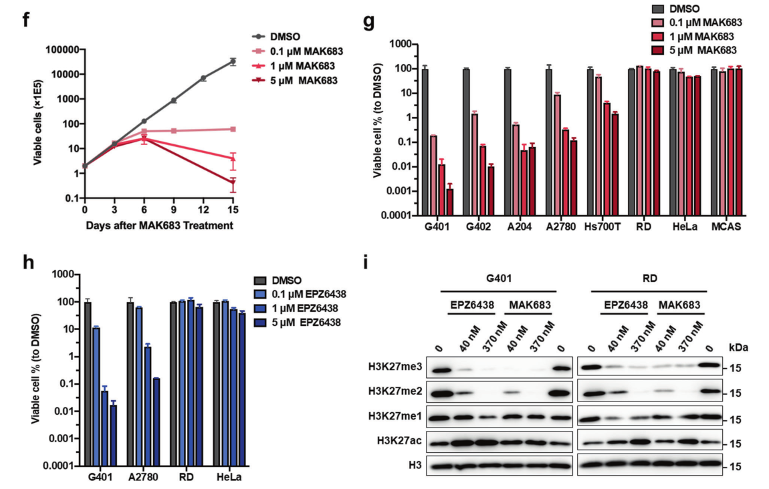
具有 SMARCB1 缺陷的恶性横纹肌瘤 (MRT) 细胞G401等、具有 ARID1A 缺陷的卵巢癌细胞 A2780 和具有 SMARCA4 缺陷的胰腺癌细胞 Hs700T均对 MAK683 处理敏感,而MAK683对PRC2的抑制作用在RD、HeLa细胞中并不明显(Fig 1f-h)。但在上述细胞中均观察到了H3K27ac(乙酰化)的增加(Fig 1i),表明PRC2抑制剂发挥作用与H3K27ac相关。
PRC2抑制剂导致H3K27me3的高表达
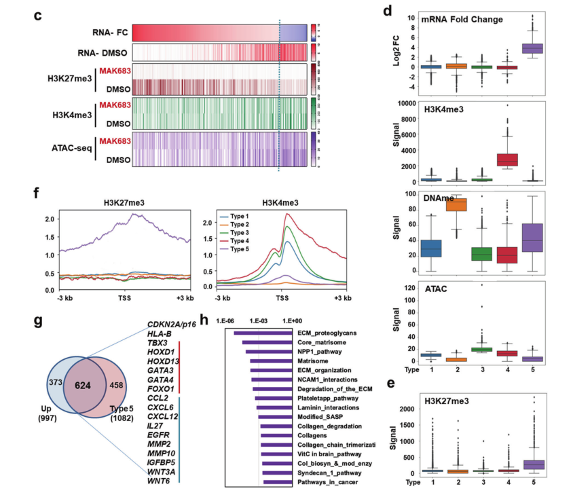
为进一步剖析与PRC2抑制剂相关的表观基因组变化,研究人员们对G401进行了全基因组亚硫酸氢盐测序 (WGBS)及转座酶可及染色质 (ATAC-seq)分析。为找出PRC2抑制上调基因的表观遗传特征,研究人员使用mRNA表达、DNA甲基化、H3K4me3和ATAC-seq的数据进行聚类,得到了5种不同的基因类型:其中2型表现出高 DNA 甲基化,4型表现出高H3K4me3水平,而5型富集了大部分上调基因(Fig 2d)。5型的H3K27me3信号明显高于其他类型(Fig 2e),且在TSS周围显示出明显的峰值(Fig 2f)。在富集分析中,富集的基因包括 COL4A1、COL4A2、COL4A4、COL4A5、FBN2 和 LAMB1等典型的基底膜标志物(Fig2h)。这些富集的途径/基因表明PRC2抑制剂在肿瘤中诱导上皮的分化和ECM重组。
PRC2抑制剂诱导肿瘤细胞的衰老表型
PRC2 抑制剂上调基因可能是肿瘤敏感性的驱动因素,研究人员们进行基因集富集分析 (GSEA)发现:“衰老通路”和“SASP”(senescence-associated secretory phenotype,衰老相关表型)在 MAK683 处理的样品中显著富集(Fig 3a)。启动子上表现出高 H3K27me3 和阳性H3K4me3修饰特征的基因聚集在5型基因组中(Fig 3b),除了SASP 上调外,MAK683 处理还增强了肿瘤细胞中的 SA-β-gal(衰老相关β半乳糖苷酶)活性。研究人员们通过定量 PCR(qPCR)证实了 CDKN2A/p16、HLA-B、GATA4 和SASP 基因(包括 BMP6、CCL2、CCL25 和 MMP2)在多细胞中强烈上调。在 MAK683诱导的细胞衰老中,出现G0/G1 细胞周期停滞和 p16蛋白增加(Fig 3d-e)。
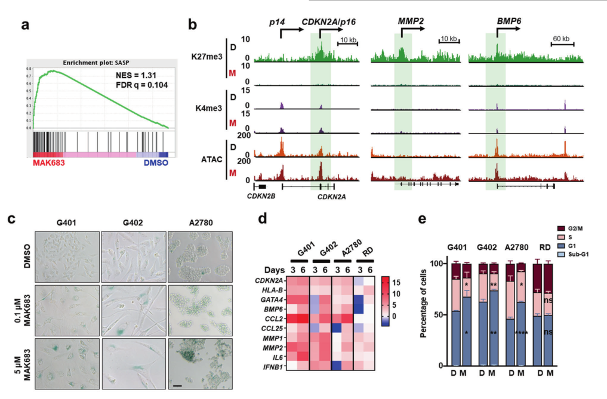
MAK683处理的G401异种移植物细胞表现为Ki-67水平降低与SA-β-gal活性增加(Fig3g-j),包括 GATA4、CCL2、IL6 和 IL1B等在内的典型 SASP均呈上调趋势(Fig 3k)。
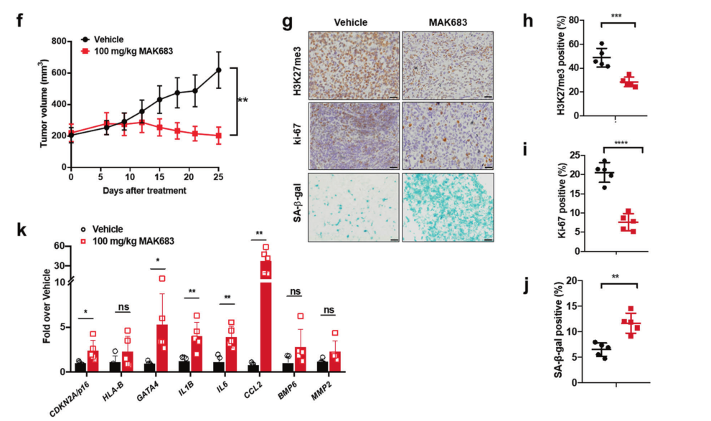
这些结果表明PRC2抑制剂在肿瘤细胞以及肿瘤异种移植物中诱导细胞衰老特征的出现,即PRC2抑制剂可能通过诱导肿瘤细胞衰老发挥治疗作用。
PRC2抑制剂促进体内肿瘤分化、衰老和免疫浸润
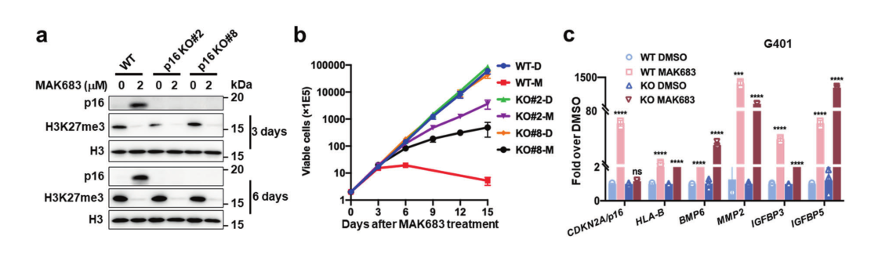
在许多癌症(包括鼻咽癌、乳腺癌、白血病和卵巢癌)中,CDKN2A/p16是抑制 PRC2 后阻断肿瘤细胞增殖的关键靶点,但研究人员经过验证发现p16缺乏并没有改变 H3K27me3 的水平。表明p16 KO不妨碍SASP基因的去抑制,它们由PRC2独立调节。
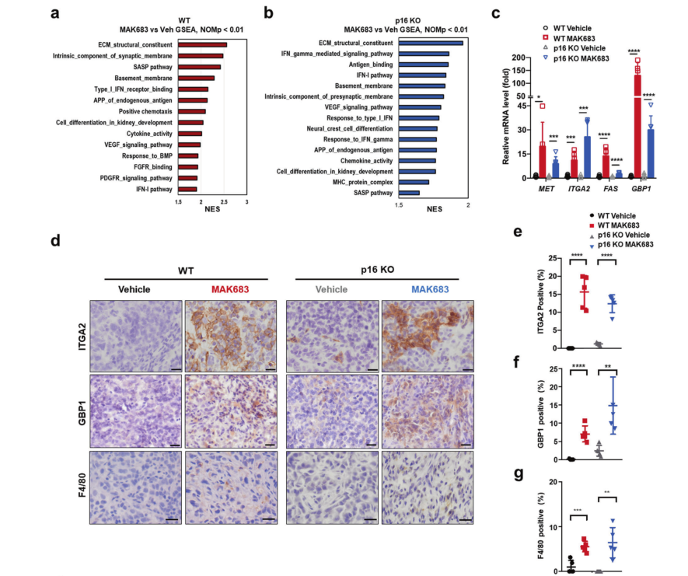
在MAK683处理后的肿瘤中,GSEA显示ECM成分、突触膜成分和基底膜途径显著富集,SASP通路和ECM在MAK683治疗的肿瘤中均明显上调(Fig5a-b)。qPCR分析也证实它们在MAK683处理的 WT和 p16 KO肿瘤中上调(Fig5c),且ITGA2 和GBP1蛋白(SASP相关蛋白)的表达也显著增加(Fig5d-f)。这些结果表明PRC2抑制剂会促进体内肿瘤细胞的分化、衰老相关炎症和免疫浸润的发生。
结束语
破译靶向治疗的分子药理学机制对于临床应用最大化至关重要,在这项研究中,研究人员们结合单细胞测序、基因富集分析等方法揭示了PRC2抑制剂的药理机制——即诱导肿瘤细胞发生衰老改变以发挥其抗癌功效,并提出PRC2抑制剂与PD-1治疗和/或CDK4/6抑制剂的组合可能是一种有效的临床策略。这也在提示我们,如果可以将测序、富集分析等方法与基础实验灵活结合,或许可以在研究中起到事半功倍的效果。













