长时间以来,肿瘤组织学分类被认为是判断患瘤及分级的国际重要标准,不知大家是否发现,近些年,在临床实践中,研究者似乎不再局限于组织学标准来判断如何治疗患者,更多的是通过免疫标志物,即“靶点”。这也就解释了为什么一种靶向药有多种看似毫不相干的适应症被研究和获批!
在过去的十年,偶联技术的突破、新型连接子和有效载荷的引入,几种新型抗体-药物偶联物(ADC)已被批准用于治疗实体肿瘤。随着许多表面靶点在不同癌症组织学中表达的认识,ADC同样被越来越多地被评估于各种不同组织学的扩展适应症。本篇综述于今年三月发表在“A Cancer Journal for Clinicians”(2022年影响因子为286.130分),在本篇综述文章中,作者总结了FDA目前对ADC在实体肿瘤领域的获批情况,并讨论了ADC在多组织学领域扩张带来的挑战和机遇。
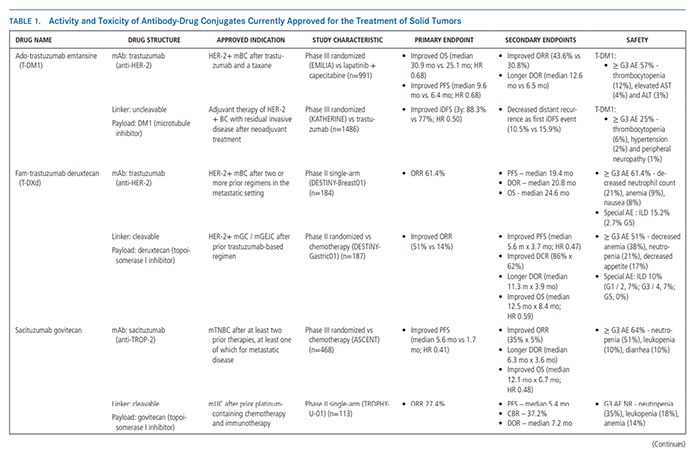
自2013年以来,FDA已批准5个ADC用于6种适应症的实体肿瘤治疗,分别为:Trastuzumab Emtansine(T- DM1)和 Trastuzumab Deruxtecan (T- DXd) 用于 HER2阳性乳腺癌;
Trastuzumab Deruxtecan用于HER2阳性胃癌;Trastuzumab Emtansine(T- DM1)扩展至HER2+早期乳腺癌Sacituzumab Govitecan用于三阴性乳腺癌Sacituzumab Govitecan和Enfortumab Vedotin用于尿路上皮癌;
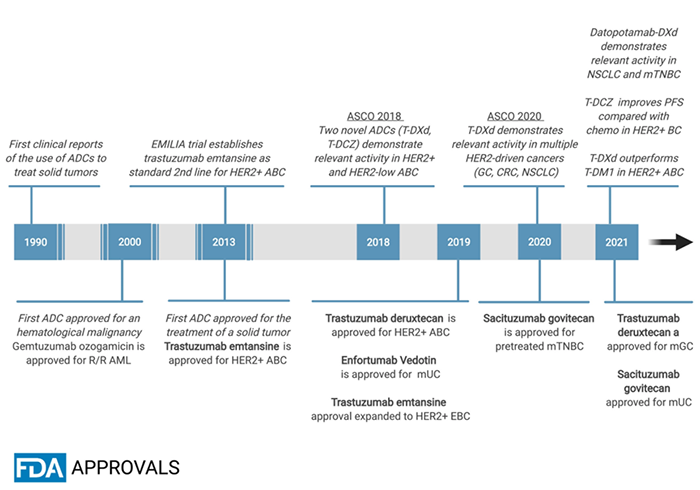
图注:用于实体瘤治疗的抗体-药物偶联物(ADC)的开发里程碑事件
图注:目前已批准用于实体肿瘤治疗的抗体-药物偶合物的活性和毒性除了上面提到的适应症外,目前批准用于实体肿瘤的5种ADC也显示了跨其他组织学亚型的活性。也不奇怪,HER2、Trop- 2、nectin- 4和多种其他抗原的确在各种各样的癌症类型中都有相应比例的表达。因此作者大胆提出假设:ADC可以在实体恶性肿瘤中获得广泛的活性谱!
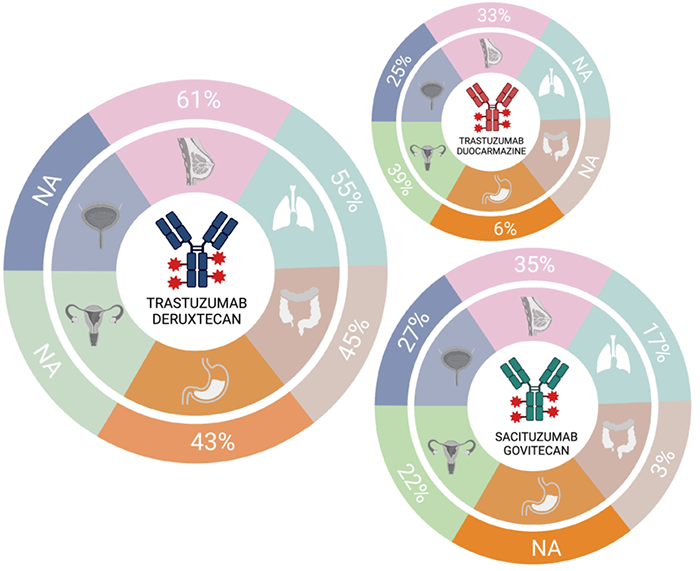
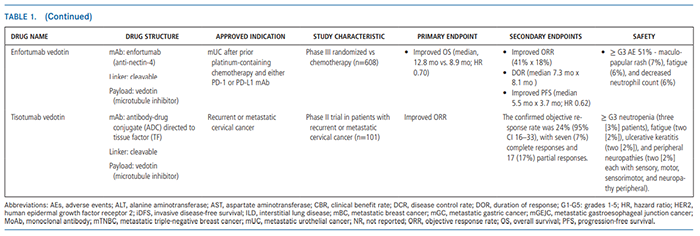
图注:在临床试验中,几种代表性新型抗体药物偶联物(ADC)对多种癌症类型均具有ORR响应由于具有高DAR、可切割连接子和可引起旁观者效应的膜透性有效载荷,新一代ADC理论上可以在任何表达靶向抗原的肿瘤中发挥抗癌活性,这一理论目前正在几个进行中的一篮子试验中被验证(包括在多种肿瘤组织学中测试ADC,通过生物标志物选择等)。
举个例子:T-DM1首次获批用于实体肿瘤患者的临床应用时,FDA将T- DM1的早期试验限制在BC患者,因显著疗效(ORR, 44%)和总体安全性而被快速获批。而在几年后,T- DM1在其他HER2过表达癌症类型中的后续试验也取得了次优的临床活性。当然,“次优”可能是由于各种因素:HER2的空间和时间异质性,肿瘤基因组的潜在复杂性,以及在特定肿瘤组织学中损害药物传递和活性的肿瘤微环境的关键差异等等。而现在的ADC设计工艺的成熟可以克服这些障碍,这进一步拓宽了ADC的适应症领域。如T- DXd和sacituzumab govitecan——这两种药物都被FDA在<2年的时间内批准治疗两种不同的癌症类型。
大家是否和我一样,认为靶向抗原表达越高的肿瘤类型,相应的ADC就能发挥更佳的治疗作用?这种固向思维已经被证明是有误的!ADC的预测性生物标志物复杂得多!
为什么靶向HER2的ADC-trastuzumab deruxtecan对低水平表达HER2的肿瘤显示出了显著的活性?此外,为什么T- DM1在HER2表达的NSCLC的患者中表现出很少的活性,但在HER2突变的NSCLC患者中表现出更多的活性?同样, T- DXd在HER2表达NSCLC患者中仅显示中度活性,而在HER2突变的晚期肺癌患者中显示惊人的55% ORR?(对于后者,据猜测可能是因为HER2突变增加了ADC的结合和内化)。第一、ADC的最佳生物标志物似乎是针对某种特定匹配的化合物,相同的生物标志物根据ADC的特点表现出不同的作用能力。其次、判定准确的生物标志物可能有助于患者选择特定癌症类型的ADC(例如,NSCLC中的HER2突变)。第三,没有选择生物标志物而开发和批准的ADC,其活性似乎取决于靶点的表达。因此进一步研究预测性生物标志物是有必要的,以提高其治疗价值和帮助临床决策。
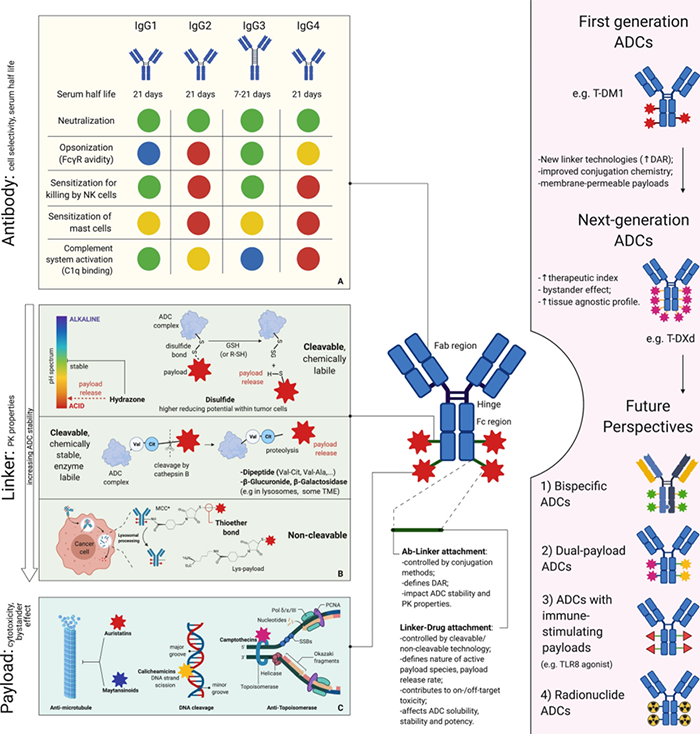
图注:新型抗体-药物偶联物(ADC)的主要特征及其对未来药物开发的可能意义①确定多种肿瘤类型共有的抗原非常重要,利用RNA测序和蛋白表达数据来预测最合适的靶向抗原策略正在开发中。这些策略可以为未来ADC的设计提供信息,使癌症抗原图谱的开发成为可能。
②值得注意的是,抗体递送药物最近已经扩大到化疗药物之外。例如,放射性核素偶联抗体的早期临床试验正在进行中,旨在有选择性地提供放射性有效载荷;此外,人们正在尝试将ADC与免疫刺激分子结合,以诱导靶向抗肿瘤免疫反应和/或协同免疫检查点抑制;携带双重不同有效载荷的ADC最近在HER2阳性BC模型中显示了克服HER2异质性的能力等等。③另一种有希望的策略设计是双特异性抗体药物偶联,抑制多种途径或调节免疫效应物与肿瘤细胞之间的结合。有研究者将auristatin有效载荷与zanidatamab连接,获得了新的化合物ZW49,一种双特异性ADC,目前正处于早期试验阶段。④与其他抗癌药物的药物联用有可能提高ADC的活性范围。潜在的协同作用可以通过多种方式实现,例如,利用ADC介导的免疫原性细胞死亡来提高免疫治疗剂的活性,或者通过药理诱导ADC靶向抗原的上调。联合应用已在多项临床试验中进行,未来几年会有一定突破。
[1] Tarantino P, Carmagnani Pestana R, Corti C, Modi S, Bardia A, Tolaney SM, Cortes J, Soria JC, Curigliano G. Antibody-drug conjugates: Smart chemotherapy delivery across tumor histologies. CA Cancer J Clin. 2022 Mar;72(2):165-182. doi: 10.3322/caac.21705. Epub 2021 Nov 12. PMID: 34767258
文字来源:医药速览