
背景介绍
PD-1主要表达于淋巴T细胞和淋巴B细胞,而其配体PD-L1广泛表达于肿瘤细胞以及众多类型免疫细胞表面。Nivolumab作为广为人知的Anti-PD-1单抗,因其较为可靠的临床疗效,已经被批准用于二线晚期非细胞肺癌的治疗[1]。但是Nivolumab作为单药应用时,仅有20%患者存在持续疗效反应。并且,基于肿瘤细胞表达PD-L1水平进行Nivolumab疗效预测价值并不十分可靠。近年来越来越多的数据表达肿瘤微环境的免疫细胞检测也许对预测anti-PD-1的疗效反应存在明显价值,但是目前仍未研究同意使用肿瘤组织免疫细胞PD-L1+表达水平和CD8+浸润性免疫细胞数量等作为NSCLC免疫治疗预测指标。
因为NSCLC免疫检测点抑制剂治疗中,微环境中特异性免疫细胞在肿瘤炎症反应和抗肿瘤反应中的作用仍未清晰,这也是该篇研究的出发点。通过肿瘤组织免疫组化,该研究重点挖掘肿瘤细胞表达PD-L1以外的其他免疫指标表达水平。基本思路是Nivolumab作为化疗后的二线治疗,在免疫治疗前获得肿瘤组织标本进行免疫组化分析标本上的肿瘤细胞PD-L1、CD8+ 浸润性T细胞以及肿瘤微环境基质中的PD-1+、PD-L1+、CD3+T细胞、CD4+T细胞、CD8+T细胞的表达水平,随后分析其与Nivolumab免疫治疗产生的持续性临床获益(durable clinical benefit,DCB)和总生存期(overall survival ,OS)的关联性。
方法
论证流程图
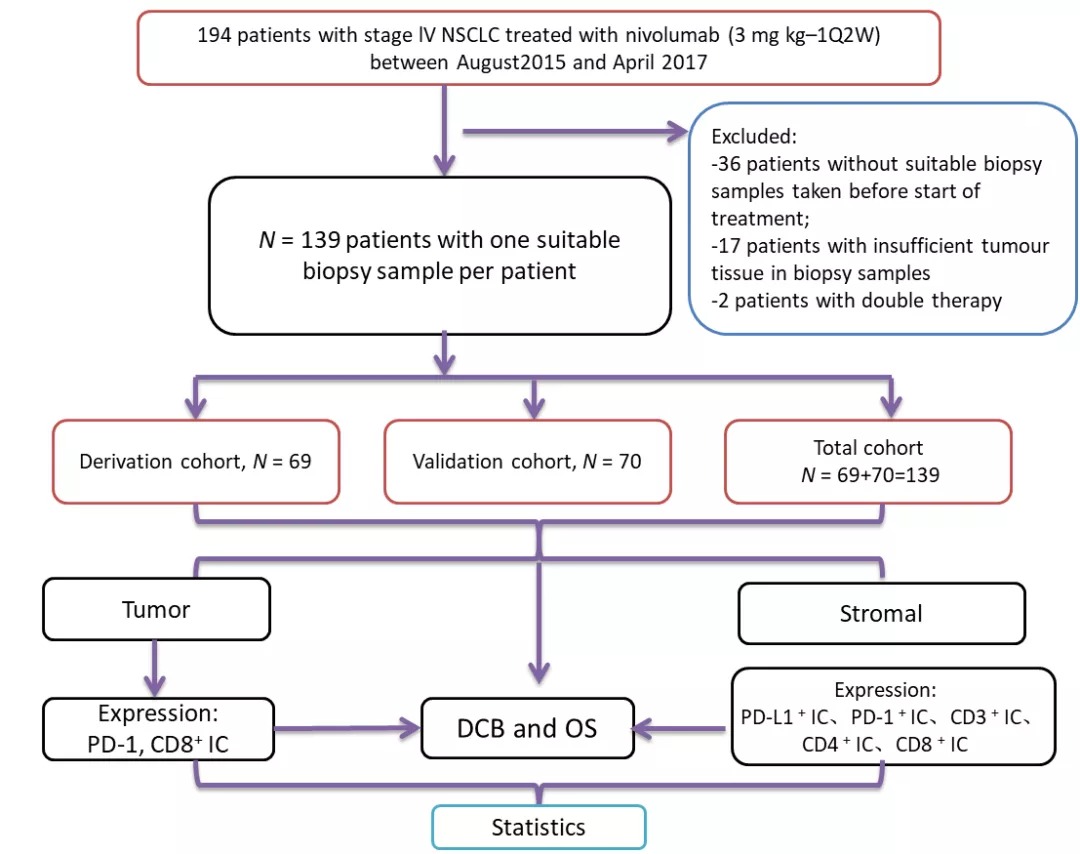
受试者及样本
自从针对NSCLC的肿瘤免疫治疗被引入荷兰以来,患者临床特点、治疗转归、不良反应等相关数据被很好的收入于国家肺癌免疫治疗数据库。因此,本次研究引用了该数据库中自2015年8月至2017年1月在荷兰阿姆斯特丹大学医学中心进行Nivolumab免疫治疗(3 mg/kg Q2W)的晚期NSCLC患者相关数据。对于每一个合格的受试者,将会回顾性获得其包含了足够多肿瘤细胞(至少100个肿瘤细胞)以及最好在石蜡包埋前未脱钙的免疫组化样本,该样本必须来自Nivoluma免疫治疗之前,且在最后一次铂类化疗前或后。
肿瘤PD-L1表达评分
整个标本中PD-L1染色的肿瘤细胞百分比分为以下几类:<1%、1-5%、5-10%、10-25%、25-50%和≥50%。肿瘤PD-L1表达以及其他免疫组化参数的评估由经验丰富的胸科病理学家(ET)进行,并对治疗结果进行盲测。
免疫细胞浸润评分
通过评估基质组织中免疫细胞的PD-L1+、PD-1+、CD3+、CD4+、CD8+的染色和肿瘤组织中CD8+免疫细胞来评估免疫细胞浸润情况。对于基质的评估,癌周区域需要被评分,因为该区域的潜在预测价值,而该区域被认定为是基质直接接触肿瘤细胞的区域。在基质和肿瘤部分的免疫细胞细胞被评分为非浸润性、低浸润性、中度浸润性和高浸润性。为了确保更详细的分类,我们在现有的偶尔出现免疫细胞的规模上增加了一个额外的类别“极低浸润”。在非均匀浸润情况下,可识别浸润类别得分最高。
临床数据收集
从可用的数据库中提取了患者的性别、治疗开始时的年龄、表现评分和肿瘤组织学等临床数据。获取在免疫治疗开始前6周内的胸部+/-腹部CT作为基线,并且每6周进行一次反应评估,或对已经出现部分缓解的患者,每3月进行一次CT评估。
治疗转归
1.这项研究的主要结果测量指标是持续临床获益(durable clinical benefit,DCB):即为经RECIST v1.1定义为nivolumab治疗开始后≥6个月的完全缓解(CR)、部分缓解(PR)或疾病稳定(SD)的总和; 2.首次反应评估前已患病或病情恶化的患者被指定为无DCB患者。
统计分析
对于两组未配对的差异,二分变量或序数变量采用chisquare检验,对于连续变量采用独立样本t检验或Wilcoxon秩和检验(当数据不服从正态分布时)。在前期研究的基础上,将基质CD8+和肿瘤CD8+免疫细胞浸润、基质PD-1+和CD8+免疫细胞浸润、基质PDL1+和CD8+免疫细胞浸润等数据整合起来。最终数据通过软件SPSS以1:1的比例随机分为衍生队列和验证队列。P值<0.05被认为差异有统计学意义。
结果
1.样本收集以及临床特点
如Figure 1a所示,自2015年8月至2017年4月期间,在荷兰阿姆斯特丹大学医学中心总计有194名晚期非小细胞肺癌患者曾使用过Nivolumab进行肿瘤免疫治疗,但有55名患者因缺少肿瘤组织切片、切片肿瘤组织不充分或因同时含TKI靶向治疗及免疫治疗的联合治疗等原因被排除,最后成功入选139名患者,每个患者选择一个合适的肿瘤病例切片样本进行数据收集,采用SPSS统计软件随机以1:1的比例分入发现队列和验证队列。随后,对发现队列和验证队列的患者临床特点进行统计,发现两组受试者的平均年龄、组织切片数量、性别、肿瘤病理类型、ECOG体力状况评分、DUB比例均未显示出统计学差异,如Table 1所示。
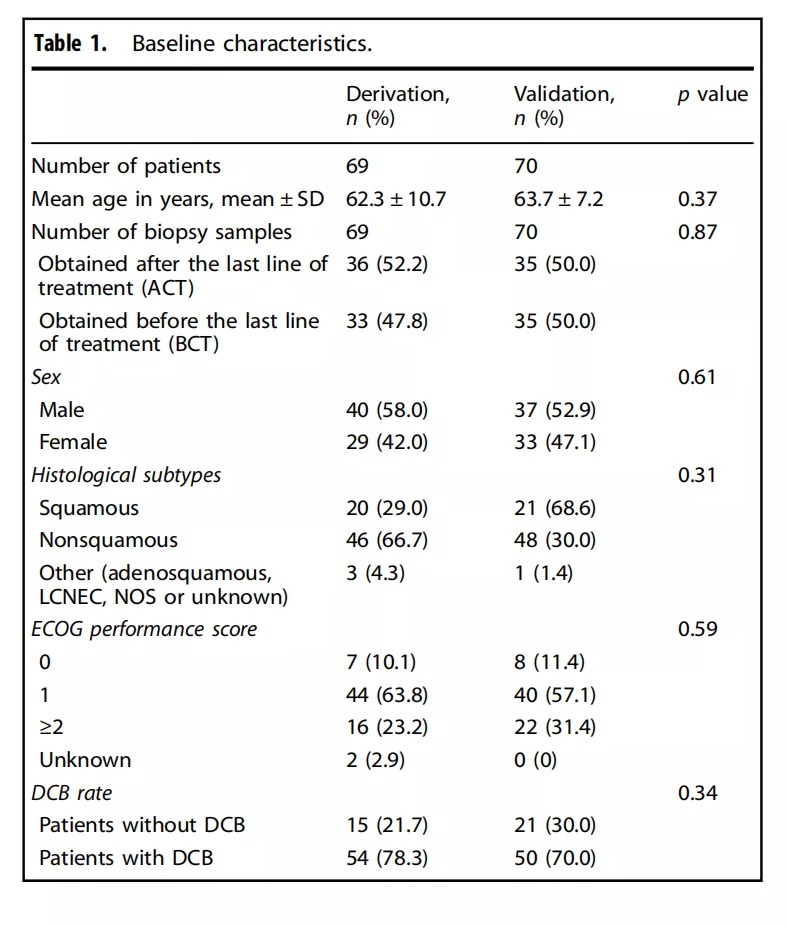
同时,分别对发现队列和验证队列的肿瘤组织进行PD-L1表达的分析,结果显示发现队列和验证队列两组肿瘤细胞的PD-L1表达水平无统计学差异,并且PD-L1阴性组(<1%)占绝大多数的比例(如Figure 1b所示)。但是通过对比Response和Non-response组的肿瘤细胞PD-L1表达水平变化,该研究者发现Response组的肿瘤样本高表达PD-L1(>50%)的比例明显升高(DCB rate 75%, OR13.6, 95% CI 2.3–79.0)(如Figure 1c所示)。
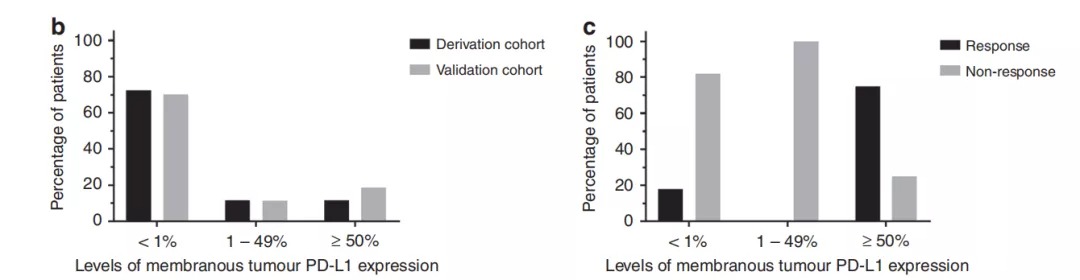 2.发现队列的肿瘤细胞和基质中的PD-1、PD-L1、CD3、CD4和CD8表达水平与患者DCB、OS的相关
2.发现队列的肿瘤细胞和基质中的PD-1、PD-L1、CD3、CD4和CD8表达水平与患者DCB、OS的相关
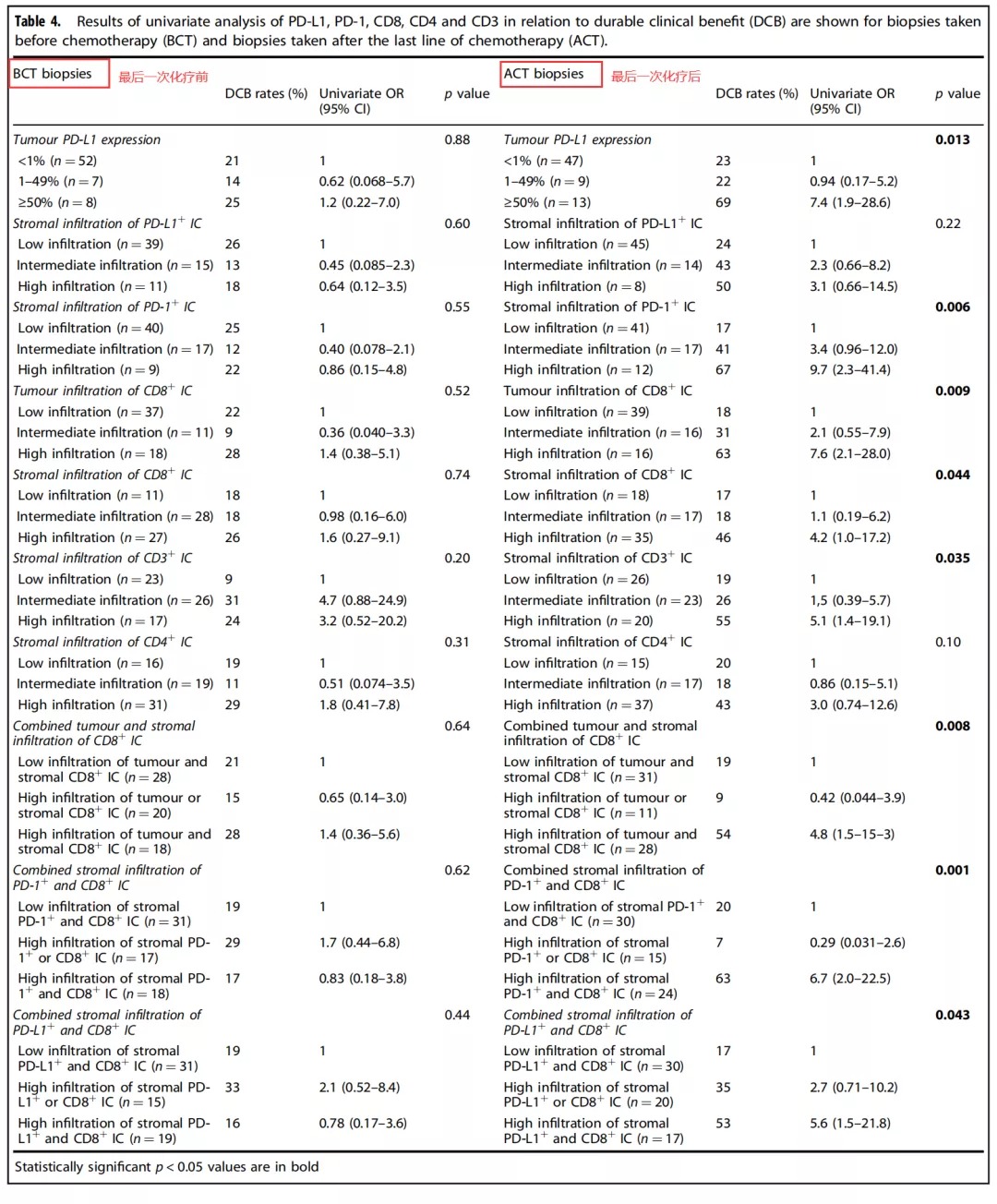
Table 2:在评估发现队列的肿瘤切片标本中的诸如PD-L1+、PD-1+、CD8+、CD4+和CD3+ 等免疫标记物表达水平与DCB的相关性分析中,通过单变量分析发现基质PD-1+ 免疫细胞(immune cell,IC)浸润、基质CD3+ IC浸润、基质CD4+ IC浸润、肿瘤合并基质CD8+ IC浸润、基质PD-1+联合CD8+ IC浸润、基质PD-L1+联合CD8+ IC浸润等均与DCB有明显的相关性(如Table 2)所示。但是遗憾的是经过多变量分析,仅仅提示肿瘤细胞表达PD-L1水平与DCB存在正相关(P=0.041),其余免疫标志物表达水平并无法确认这种相关性。
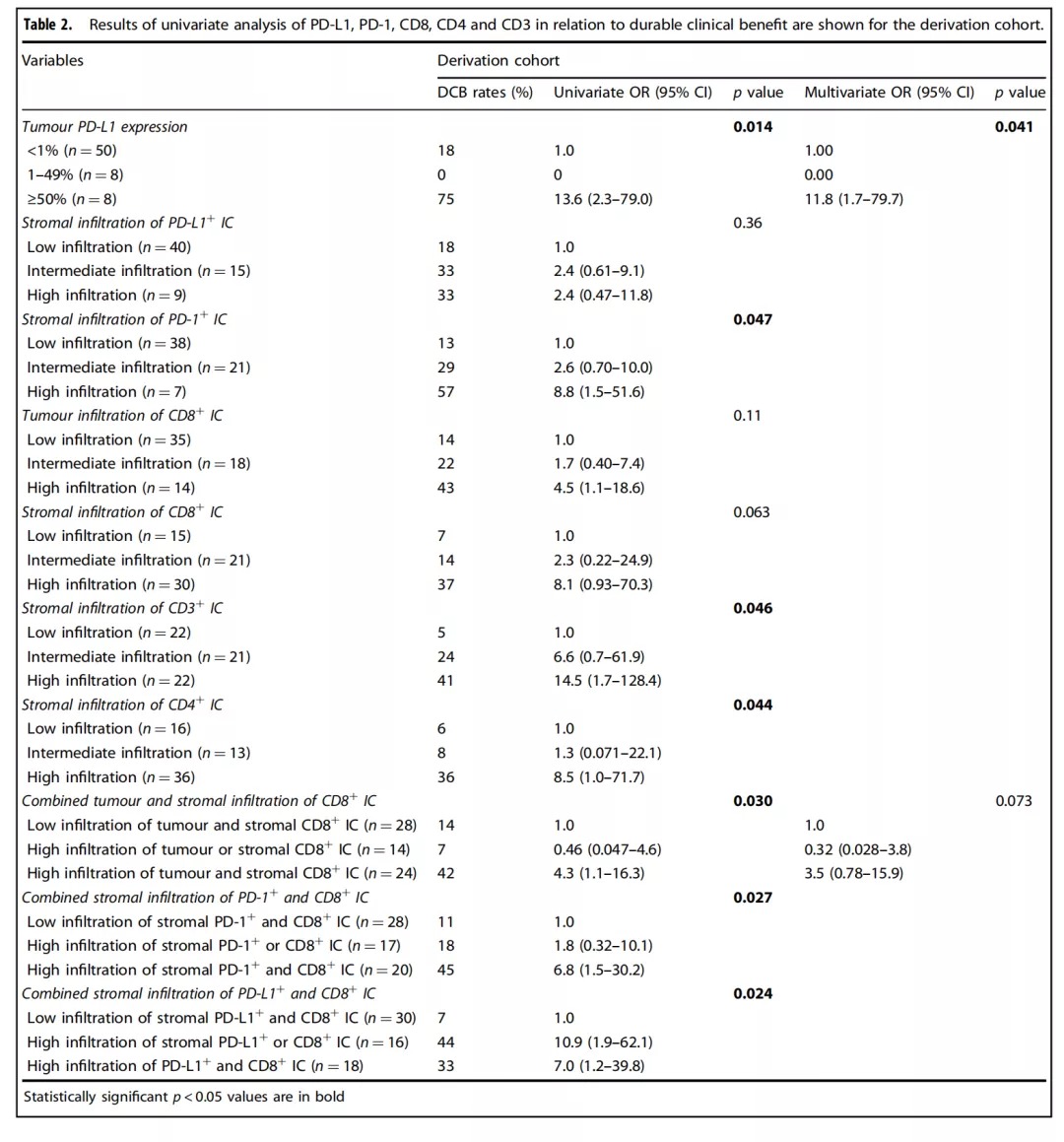
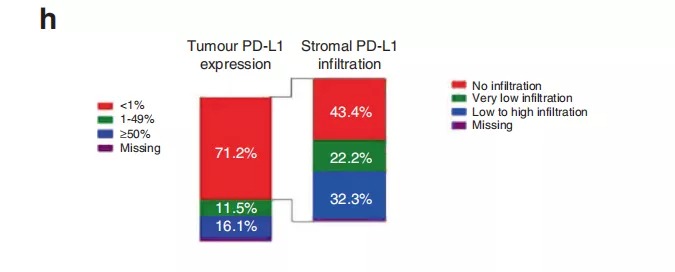
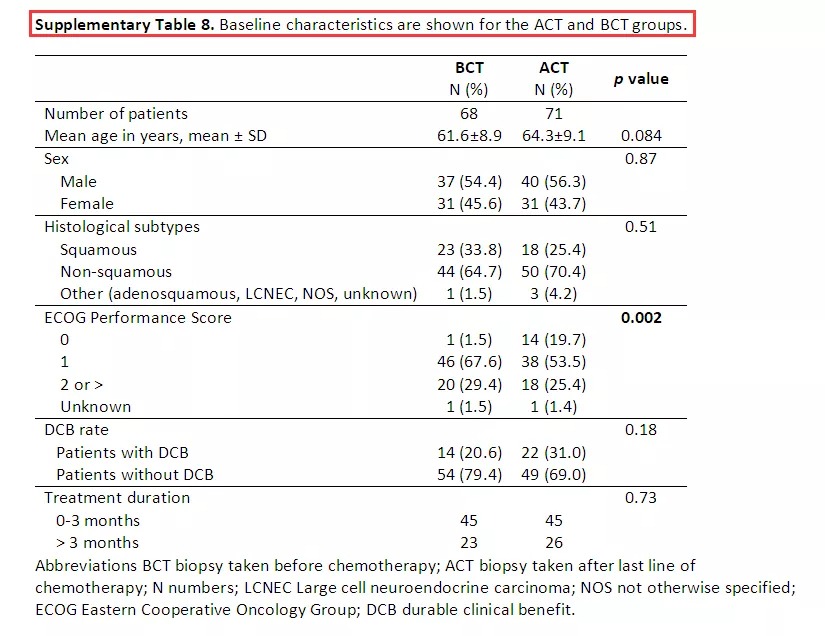
Table 3::为了进一步分析发现队列和验证队列的PD-L1+、PD-1+、CD8+、CD4+和CD3+的表达分布以及其与OS的关系,该研究组进行了详尽的数据统计,具体如Table 3所示。结果提示发现队列和验证队列的肿瘤病理切片免疫组化中PD-L1+、PD-1+、CD8+、CD4+和CD3+的表达分布没有显著性差异。然而在针对OS的相关性分析中,发现队列的肿瘤细胞PD-L1+高表达、基质CD8+ IC高度浸润、基质CD3+ IC高度浸润、基质CD4+ IC高度浸润、间质和肿瘤联合CD8+ IC高度浸润、基质PD-1+联合CD8+ 表达IC高度浸润、基质PD-L1+联合CD8+ 表达IC高度浸润等因素均与OS延长具有明显的相关性。此外,在验证队列中肿瘤组织CD8+ IC高度浸润、基质CD8+ IC高度浸润、基质PD-L1+联合CD8+ 表达IC高度浸润以及基质PD-1+联合CD8+ 表达IC高度浸润等因素均与OS延长相关。 因为在之前有关DCB相关性的发现队列得出的多个结论并未能够在验证序列中得到验证,该研究组决定把两组数据合并从而扩大样本量,形成联合组。因此,在联合组中,约15%的患者肿瘤细胞膜PD-L1+高表达(≥50%),71.2%的患者肿瘤细胞膜PD-L1+高表达(<1%)。但是在肿瘤PD-L1低表达组中,有超过50%的基质IC具有PD-L1表达,正如Figure 2h所示。 Supplementary Table 8: 最后一次化疗前后获取标本的临床特征比较。了分析病理切片来源的时间点(最后一次全身化疗之前或之后)对统计结果的影响,该研究组进行了回顾性分析,结果提示除了ECOG体力评分外,其他基本临床特点没有显著性差异。 Table 4: ACT组,单因素分析提示包括诸如基质PD-1+浸润、基质CD8+ IC浸润、基质CD3+ IC浸润、间质和肿瘤均CD8+ IC浸润、基质PD-1+联合CD8+ 表达IC高度浸润、基质PD-L1+联合CD8+ 表达IC浸润等因素均与DCB相关(如Table 4所示)。但是在BCT组,这种相关性并未得到证实。 Table 5: ACT组,多因素分析再次提示在ACT组中肿瘤PD-L1+ 表达、间质联合肿瘤 CD8+ IC浸润这两个因素均改变了患者的DCB值。 在本次回顾性研究中发现在衍生组和ACT组中,肿瘤的PD-L1表达对Nivolumab免疫治疗产生的DCB具有预测价值,但在BCT组中这种预测价值被极大削弱。基于上述试验结果,研究者发现肿瘤微环境中的肿瘤细胞与基质的不同组合对Nivolumab疗效有着明显影响。在本次研究中发现基质PD-L1+联合CD8+ 表达IC高度浸润对DCB和OS均有明显改善作用,这提示Nivolumab可能通过激活基质免疫细胞从而导致肿瘤消除。同时,本研究揭示了基质CD4+ IC在晚期NSCLC免疫治疗中的潜在价值。并且,本研究展现出了最后一次化疗前后所获取的病理标本对免疫治疗的预测截然不同,这提示了化疗不仅导致了肿瘤细胞消除,也明显改变了肿瘤免疫微环境。有研究表明顺铂可以促进肿瘤细胞和抗原呈递细胞MHC I的表达,并促进免疫效应细胞的增殖和降低肿瘤免疫抑制微环境[1]。 值得注意的是该研究中79%的晚期NSCLC患者PD-L1表达为阴性,这与多个相较PD-L1阴性比率明显升高。一个可能是PD-L1阴性的判定标准存在一定程度的差异。另外是研究者使用广泛的免疫细胞标记物和PD-L1对活检标本进行染色,以求更全面地评估表达PD-L1的不同细胞类型,从而降低了肿瘤细胞PD-L1的表达水平。例如当肉眼检视细胞核无法明确区分恶性细胞和免疫细胞时,使用CD4和PD-L1双染色可有助于区分恶性细胞和免疫细胞,从而防止过高估计PD-L1评分。 但是对于本次研究结果的解释,仍存在不少挑战。一个是在单一病理切片上进行过多的免疫标志物、PD-L1和PD-1等进行染色,过于复杂,可能导致分类错误。另外,肿瘤细胞PD-L1的表达是易变性的,这种易变形常难以排除诸如宿主、TNM分期等因素带来的影响。最后,通过SPSS随机1:1分配到衍生组和验证组的患者,衍生组和验证组的多个研究结果并不一致,并且这种不一致在联合组中再次体现。 总之传统的全身化疗等也许改变了免疫微环境,所以在进行Nivolumab免疫治疗之前最好再进行一次病理切片免疫组化评估免疫微环境。同时未来需要更大规模的研究以求证实肿瘤和基质浸润性CD8+ 免疫细胞对免疫治疗的疗效预测价值。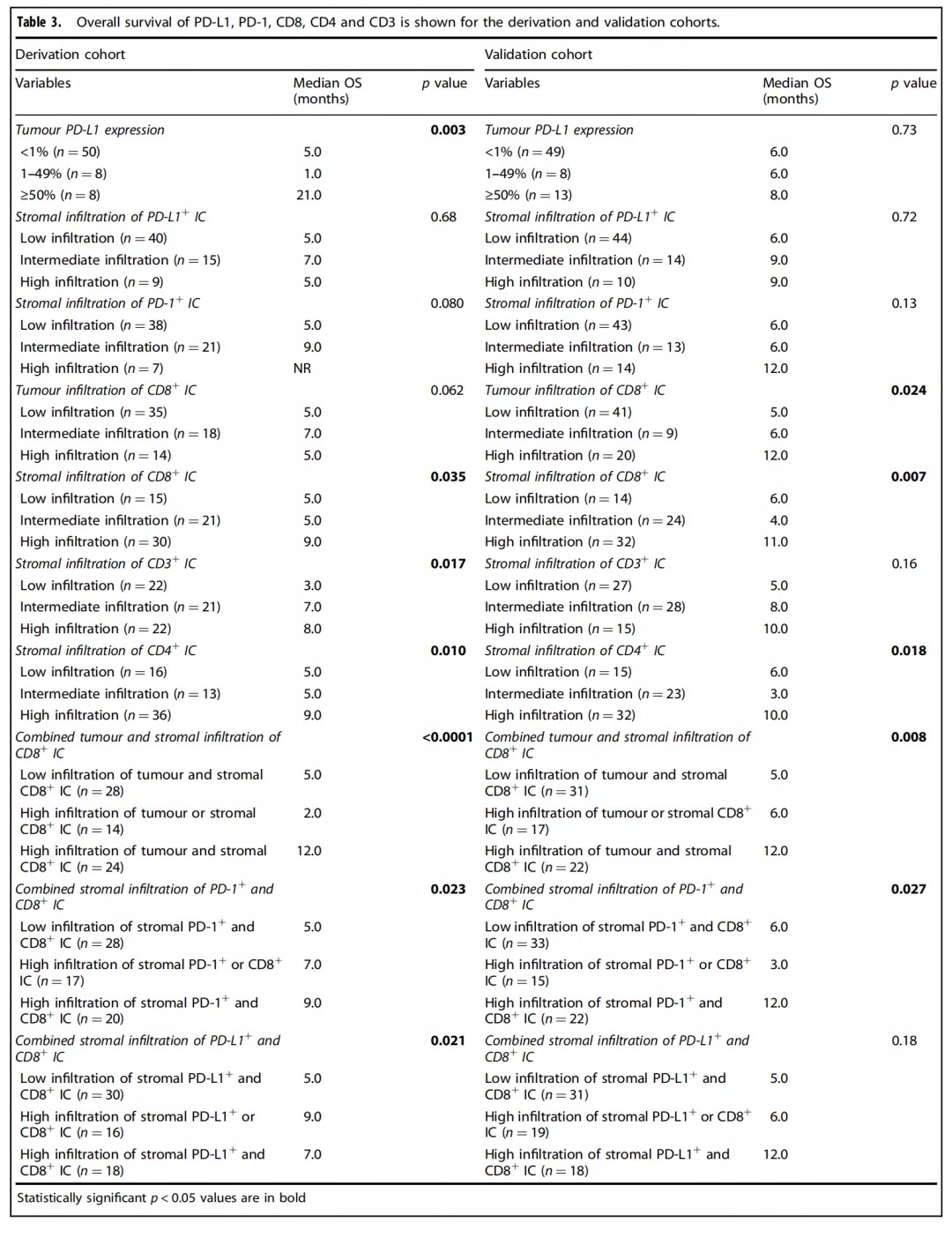
3.在两组联合分析中,多变量分析显示肿瘤和间质的CD8+ IC浸润与DCB相关,并且免疫细胞标志物表达与OS存在明显相关性
4.化疗对病理切片数据的影响分析
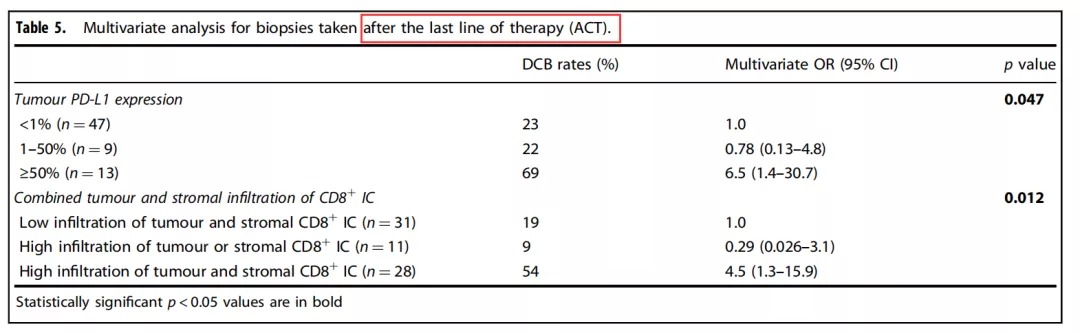 此外,该研究发现ACT和BCT组在晚期NSCLC进行Nivolumab免疫治疗后的OS上并没有出现显著性差异。但ACT组中,该研究组发现基质PD-1+ IC高浸润、肿瘤CD8+ IC高度浸润、基质CD3+ IC高度浸润、基质CD4+ IC高度浸润、间质和肿瘤均CD8+ IC高度浸润、基质PD-1+联合CD8+ 表达IC高度浸润、基质PD-L1+联合CD8+ 表达IC高度浸润等因素均可明显延长OS。但是在BCT组中,这种相关性并未得到确认。因此,也许BCT前的肿瘤病理标本免疫标志物测定对预测患者采用Nivolumab免疫治疗的疗效并不可靠。
此外,该研究发现ACT和BCT组在晚期NSCLC进行Nivolumab免疫治疗后的OS上并没有出现显著性差异。但ACT组中,该研究组发现基质PD-1+ IC高浸润、肿瘤CD8+ IC高度浸润、基质CD3+ IC高度浸润、基质CD4+ IC高度浸润、间质和肿瘤均CD8+ IC高度浸润、基质PD-1+联合CD8+ 表达IC高度浸润、基质PD-L1+联合CD8+ 表达IC高度浸润等因素均可明显延长OS。但是在BCT组中,这种相关性并未得到确认。因此,也许BCT前的肿瘤病理标本免疫标志物测定对预测患者采用Nivolumab免疫治疗的疗效并不可靠。讨论
总结













